Метан ⚗️ структурная формула газа, строение, химические и физические свойства, получение и применение, с какими веществами реагирует углеводород
Краткая характеристика
Природный метан образуется при гниении останков живых организмов. В переводе с английского «methane» означает «болотный газ», так как чаще всего его обнаруживают в болотах и каменноугольных шахтах.
Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности.
Другими источниками вещества являются:
- термиты;
- рис-сырец;
- болотистые водоёмы;
- фильтрация природного газа;
- фотосинтез растений;
- вулканы;
- давно погибшие организмы.
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
На Земле вещество просачивается через трещины в земной коре, находящиеся на океанском дне, в больших количествах выделяется во время горных разработок и при лесных пожарах. Кроме того, недавно учёными был обнаружен новый источник газа, который никогда ранее в таком ключе не рассматривался.
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:
- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.
Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим».
Химические свойства
В химии формула метана — Ch5. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия;
- дихромат калия в кислой среде.
При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:
- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом Ch4. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: Ch5 + 2O2 → CO2 + 2h3O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Получение в промышленности и лаборатории
В промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля.
В лаборатории для получения вещества применяются следующие методы:
- Реакция гидроксида натрия с ацетатом натрия.
- Взаимодействие карбида алюминия.
- Нагревание натристой извести с уксусной кислотой. Для этой реакции необходима безводная среда, а потому в ней применяется гидроксид натрия, который является наименее гигроскопичным.
Болотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода.
К важным методам получения ацетилена из простейшего углеводорода относятся:
- термоокислительный крекинг,
- электрокрекинг.
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана.
В настоящее время газ стал часто использоваться в качестве автомобильного топлива. Но его плотность в 1000 раз меньше плотности бензина, а потому, чтобы заправить автомобиль метаном на тот же объём, что и бензином, при равном давлении необходим соответствующий бак. В таком случае для обычной поездки потребовалось бы возить прицеп с топливом.
Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции.
Парниковый эффект
Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
Влияние на организм человека
Человек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода.
Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества.
Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия.
Отличить острое отравление метаном можно по следующим признакам:
- головокружение;
- шум в ушах;
- сонливость;
- общая слабость;
- потеря координации;
- нарушение речи;
- резь в глазах;
- слезотечение;
- удушье;
- усиленное сердцебиение;
- понижение артериального давления;
- тошнота;
- приступы рвоты;
- синюшность кожных покровов и слизистых оболочек.
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения.
Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном.
Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана.
Как получить метан?
Метан – это простейший представитель предельных углеводородов. Он хорошо горит с выделением большого количества тепла, поэтому широко используется промышленностью.
Как получить метан в промышленности
Метан входит в состав природного газа и газа, сопутствующего нефтяным месторождениям. Поэтому промышленность получает метан из этих газов.
Как получить метан в домашних условиях
Метан имеет и другое название – болотный газ. Для того чтобы получить его в домашних условиях следует взять немного почвы со дна болота и поместить ее в банку, залив сверху водой. Банку плотно укупоривают и помещают в темное и теплое место. Через несколько дней можно будет заметить появление на поверхности воды мелких пузырьков газа. Образующийся метан можно отвести из банки через газоотводящую трубочку.
Как получить метан в лабораторных условиях
Получить метан в условиях лаборатории можно несколькими способами:
- Пропускание смеси сероводорода и сероуглерода через трубку, на дне которой расположена раскаленная медь: CS2 + 2H2S + 8Cu = CH4+ Cu2S. Это был самый первый способ получения метана. Позже было выяснено, что получить метан можно при нагревании смеси водорода и углерода в присутствии никелевого катализатора до 475 градусов. Без использования катализатора нагревать смесь приходится до 1200 градусов. С + 2H2 = CH4
- В настоящее время метан получают нагреванием смеси гидроксида натрия и ацетата натрия: СН3СООNa + NaOH = Na2CO3 + CH4.
- Получить чистый метан можно при реакции карбида алюминия и воды: Al4C3 + 12H2O = 4 Al(OH)3 + 3CH4
- Синтез метана может вестись и на основе соединения водорода и угарного газа: CO + 3H2 = CH4 + H2O
Как из метана получить ацетилен
Получить ацетилен из метана можно в результате нагревания последнего до температуры в полторы тысячи градусов:
2 CH4 >C2H2 + H2
Как получить из метана метанол
Чтобы получить из метана метанол следует провести несколько химических реакций. Сначала происходит реакция между хлором и метаном. Эта реакция протекает только на свету, т.к. запускается она фотонами света. В ходе этой реакции образуется трихлорметан и соляная кислота: CH4 + Cl2 > CH3Cl + HCl. Затем проводят реакцию между полученным трихлорметаном и водным раствором гидроксида натрия. В результате этого получается метанол и хлорид натрия: CH3Cl + NaOH > NaCl + CH3OH
Как из метана получить анилин
Получить анилин из метана, возможно проделав только целую цепочку реакций, которая схематически выглядит так: CH4 > C2H2 > C6H6 > C6H5NO2 > C6H5NH2.
Сначала производят нагревание метана до 1500 градусов, в результате чего образуется ацетилен. Затем из ацетилена получают бензол, используя для этого реакцию Зелинского. Для этого через нагретую до 600 градусов трубку, наполовину заполненную активированным углем, пропускают ацетилен: 3С2H2 =C6H6
Из бензола получают нитробензол: С6H6 + HNO3 = C6H5NO2 + Н2О, который представляет собой исходное сырье для получения анилина. Этот процесс идет по реакции Зинина:
С6H5NO2 + 3(NH4)2S = C6H5NH2 + 6NH3 + 3S + 2H2O.
Метан
20 век сделал автомобиль массовым. Сегодня уже невозможно представить существование человека без него. Хотя есть один безусловный фактор, который может изменить положение вещей, это цена на автомобильное топливо. Если любого водителя в любой стране спросить о стоимости горючего, он ее сразу назовёт.
Повышение цены на топливо всегда взывает недовольство. Но что будет, если цена превысит некий предельный рубеж или еще хуже нефть, из которой получают бензин и дизельное топливо просто закончится. Это абсолютно фантастическая картина, которую мы с вами вряд ли когда-нибудь увидим в реальности.
Ведь если весь вопрос в цене и наличии конкретного топлива, то достаточно его заменить и все вернется на круги своя. Тот же метан, который горит в наших газовых плитах можно использовать и для заправки авто. Это обходится примерно в двое дешевле по сравнению с бензином и соляркой.
Простой, казалось бы, вопрос, сколько в мире осталось нефти и газа? Удивительно, но доподлинно это неизвестно. Существует целый ряд факторов, которые мешают назвать конкретные цифры. Хотя бы потому, что до сих пор есть не разведанные запасы нефти и газа. Словом, более-менее точно, хотя и очень обтекаемо можно сказать одно, нефти на земле осталось меньше, чем природного газа. По очень приблизительным данным, нефти хватит лет на 80-100, а газа лет на 300. Добывается, а значит и расходуется нефть в больших объемах по сравнению с метаном, а это в свою очередь приведет к тому, что закончится она раньше, чем газ. Когда это произойдет, никто точно не знает. Но это случится и тогда, главным углеводородным топливом, в том числе и для заправки авто, станет метан.
На сегодняшний день практически все крупнейшие автопроизводители серийно изготавливают один, а то и два модельных ряда газовых авто. Это не столько дань моде, а простой экономический расчет. Стоимость газового топлива практически во всем мире ниже цены на бензин и дизтоплива, где-то на треть, а где-то и на половину. Тогда спрашивается, почему так мало машин, работающих на метане?
В первую очередь потому, что очень мало метановых заправок АГНКС. К примеру, в России около 70 000 АЗС, которые продают бензин и дизтопливо и всего чуть более 400 АГНКС реализующих метан. Если же взять основные европейские страны, то тут ситуация иная, около 130 000 АЗС и почти 4 000 АГНКС. Несмотря на отсутствие достаточного количества АГНКС, все больше автолюбителей во всем мире переходят на газомоторное топливо.
Сейчас в мире насчитывается около восемнадцати миллионов автомобилей, работающих на метане. Кто их изготавливает? Почти все автопроизводители. Транспортные средства, работающие на метане, выпускают серийно. Например, на Российском КАМАЗе уже много лет изготавливают метановые грузовики. С конца 80-х годов прошлого века КАМАЗ выпускал газодизельные грузовики, то есть работающие на смеси метана и дизельного топлива. А с 2004 года наладил производство грузовиков, работающих только на метане. Примерно пять процентов от всех производимых грузовиков теперь газовые, то есть они могут ездить только на метане. Такие метановые грузовики по экологическим нормам достигают уровня Евро-4, Евро-5. Это еще одно безусловное отличие газового транспорта от бензинового и дизельного — экологичность.
Не нужны никакие фильтры и дополнительная очистка горючего. Метан, которым заправляют автомобили, тот же самый, что горит в наших кухонных плитах. Он оставляет после себя лишь воду и углекислый газ в самой безобидной пропорции среди всех ископаемых видов топлива.
Если взять самые большие месторождения газа-метана на земле и перечислить их, времени потребуется на это очень много. Вот только часть из них, на северо-западном шельфе Австралии, около острова Калимантан, Северный Купол и Южный Парс в Персидском заливе, Иолотань в Туркмении, заподно-сибирские месторождения Уренгой и Ямбург, Штокмонское в Баренцовом море, месторождения Северного моря, Левиафан на шельфе Израиля, в Мексиканском заливе, Тринидаде и Табаго, у Восточного шельфа Бразилии. Это самые большие и самые чистые месторождения метана, а сколько их существует в принципе, никому не известно.
В России метан добывают на Сахалине, в Якутии, в старых нефтегазовых регионах на Северном Кавказе, в Астрахани, в Тимано-Печорском регионе и на огромных, даже по мировым меркам, западносибирских месторождениях. Это Заполярное, Ямбурское, Южно-Русское, Комсомольское и Уренгойское, недалеко от названного в честь него города Новый Уренгой.
Добывается метан с помощью буровых вышек. Они проделывают в земле длинные до несколько километров скважины и добираются до газоносных пластов. Затем на специальных заводах метан обрабатывают, очищают, избавляют от влаги и механических примесей, и с помощью сети компрессорных станций по трубопроводам перекачивают в города и населенные пункты. Но это один способ доставки метана потребителям. Другой, охлаждение его до криогенных, очень низких температур, когда природный газ становится жидким и его перевозят в термоизолированных ёмкостях. Этот сверхохлажденный метан называется СПГ-сжиженный природный газ. Самое интересное свойство СПГ, его колоссальное уменьшение в объёмах. При охлаждении его до -162 градусов по Цельсию, он сожмется и станет жидкостью, уменьшившись в 600 раз. Если его снова нагреть он приобретет свой прежний объем. То есть СПГ, это более компактная форма хранения и транспортировки метана. Один баллон с жидким газом, это как 600 баллонов при нормальном атмосферном давлении или 3 баллона сжатого газа при давлении 200 атмосфер.
Многие страны уже используют СПГ для автомобильного транспорта, а некоторые пошли еще дальше. Швеция, одна из первых стран которая стала использовать СПГ для заправки огромного газового парома Викинг. Паром не экспериментальный, вполне коммерческий, он совершает рейсы из Стокгольма в Финляндию и обратно. Подобные суда выбрасывают меньше вредных веществ по сравнению с дизельными и, конечно, есть выигрыш по деньгам. Метан стоит дешевле традиционного судового топлива. Об этом вряд ли задумываются пассажиры судна, для них это просто увеселительная или деловая поездка. Покидая паром, они даже не знают, что были на самом большом среди всех газовых и самом экологичном среди всех существующих в мире судне.
Кроме судов, метан, фактически можно использовать на любых видах транспорта. В России, например, создали газовый локомотив, работающий на том же самом сжиженном природном газе. ГТ-1 – газотурбовоз на жидком природном метане мало того, что единственный в своем роде, но еще и локомотив рекордсмен. Официально признанный самым мощным среди всех на индивидуальной тяге, он провел грузовой состав весом 16 тысяч тонн, это 170 вагонов более двух километров в длину. Для заправки такого локомотива рядом с Екатеринбургом был построен мини-завод по сжижению газа-метана. В будущем на подобных газотурбовозах планируется устанавливать съемные термоизолированные баки, чтобы не локомотив приезжал на заправку, а заправленные баки подвозили к нему на станцию и там меняли на пустые.
Наверное, не случайно, что первый в истории человечества двигатель внутреннего сгорания, был газовый. Сегодня существует огромное разнообразие автомобильных силовых установок, но каждый из них рано или поздно отойдет на второй план, дав место чему-то новому, возможно еще даже не изобретенному. Однако на сегодняшний день, газомоторное топливо, это адекватная альтернатива бензину и дизельному топливу, хотя бы потому, что оно дешевле и экологичнее. Речь не идет о каких-то глобальных изменениях существующих условий на рынке сбыта, все уже давно изобретено и прекрасно работает. Осталось только сделать маленький шаг.
Ознакомиться с деталями переоборудования на метан (КПГ) Вы можете на странице нашего каталога:
https://gas-truck.ru/catalog/ustanovka-gbo
Химические свойства метана, формула, плотность, горение газа, молярная масса, применение в промышленности, термическое разложение, бромирование метана, строение молекулы
Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
Сh5 | Н | Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
Характеристика:
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
Ch5 + Cl2 → Ch4Cl + НСl
Ch5 + Br2 → Ch4Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
Ch5 + Cl2 → Ch4Cl + НСl
Ch4Cl + Cl2 → Ch3Сl2 + НСl
Ch3Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
Ch5 + Br2 → Ch4Br + Н Br
Ch4Br + Br2 → Ch3Br2 + НBr
Ch3Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
СН4 → С + 2H₂
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, Сh5 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
- спирты: 2СН4 + O2 → 2СO3OН
- альдегиды: СН4 + O2 → НСОН + Н2O
- карбоновые кислоты: 2СН4 + 3O2 → 2НСОOН + 2Н2O
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
Ch5 + НNО3 → СН3NO2 + h3O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2h3 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Химические свойства метана, формула, плотность, горение газа, молярная масса, применение в промышленности, термическое разложение, бромирование метана, строение молекулы

Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
| СH4
| Н | Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.

В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
Характеристика:
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3Cl + Cl2 → CH2Сl2 + НСl
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
СН4 → С + 2H₂
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Метан — это… Что такое Метан?
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха[2], химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека[3]. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему[4]. Накапливаясь в закрытом помещении, метан взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью. Специфична для метана реакция с парами воды, которая протекает на Ni/Al2O3 при 800—900 °C или без катализатора при 1400—1600 °C; образующийся синтез-газ может быть использован для синтеза метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %[5]. Наиболее взрывоопасная концентрация 9,5 %. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый[6].
Источники
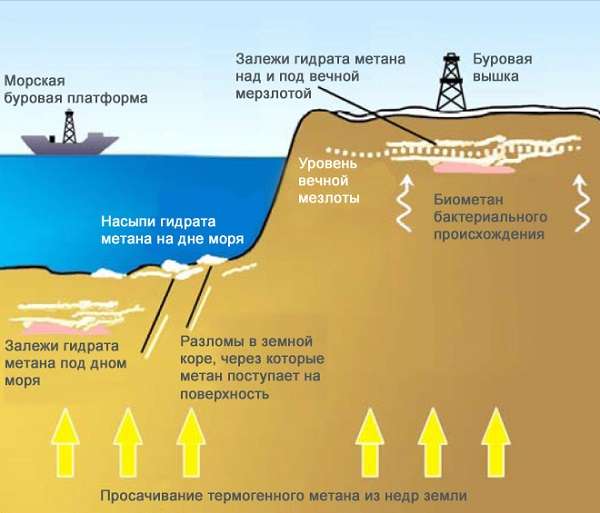
Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Получается также при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению:
- абиогенный — образован как результат химических реакций неорганических соединений;
- биогенный — образован как результат химической трансформации органического вещества;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий;
- термогенный — образован в ходе термохимических процессов.
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано[источник не указан 27 дней]-этановой смеси.
Получение
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[7]:
Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Химические свойства
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 39 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 5 до 15 процентов. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно радикальному механизму:
Выше 1400 °C разлагается по реакции:
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространенные в природе.
Применение метана
- Топливо.
- Сырьё в органическом синтезе.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, сходные с горной болезнью.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому весьма редки случаи гибели людей от вдыхания смеси метана с воздухом, от асфиксии.
Первая помощь при тяжелой асфиксии: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
Метан и экология
Является парниковым газом, в этом отношении, более сильным, чем углекислый газ, из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 21 единицу[8].
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3[9].
Ссылки
Примечания
- ↑ Обзор: Растворимость некоторых газов в воде
- ↑ Статья «Метан» на сайте «Химик»
- ↑ З. Гауптман, Ю. Грефе, Х. Ремане «Органическая химия», М. «Химия», 1979, стр. 203.
- ↑ Куценко С. А. Основы токсикологии / С.А. Куценко. — СПб.: Фолиант, 2004.
- ↑ ГОСТ Р 52136-2003
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Б. А. Павлов, А. П. Терентьев. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 3 February 2009 (англ.)
- ↑ Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»
Cинтез-газ: способы получения и применение
Определение
Понятие «синтез-газ» применяют к разным смесям монооксида углерода (СО) и водорода (Н2), которые используются для получения некоторых нефтехимических продуктов. Его в основном получают из природного газа (метана). Действительно, важнейшие вещества — аммиак, метанол и парафиновые углеводороды — получают именно из синтез-газа.
Получение
Существуют два основных метода получения синтез-газа – конверсия метана с водяным паром и парциальное (частичное) окисление. Оба метода довольно просты.

Конверсия метана с паром
Конверсия с паром состоит в пропускании метана или нафты и водяного пара над никелевым катализатором. Реакция протекает за счет разрушительной силы высоких температур и давлений, и ее следует проводить в реакторах, аналогичных печам крекинга. При этом происходят побочные процессы, при водящие к образованию СО2 и углерода. Углерод откладывается на катализаторе и дезактивирует его.
Парциальное окисление метана
Другой метод — это парциальное (частичное) окисление метана. Процесс проводят при высоких температурах без катализатора. Метод парциального окисления обычно используют для превращения более тяжелых видов сырья — от нафты до остаточного топлива — в тех случаях, когда в распоряжении нет природного газа и легких углеводородов (этана, пропана и бутана). В обоих процессах выход суммы СО и Н2 составляет 90 – 95%.
В качестве побочного продукта получают СО2, который можно удалить либо экстракцией растворителем, либо можно ввести в реакцию с водяным паром дополнительное количество метана, что даст СО и Н2. Эта реакция протекает при высоких температурах и давлениях и в присутствии никелевого катализатора.
Транспортировка
Обычно установка по производству синтез-газа бывает интегрирована в структуру завода, на котором он перерабатывается.
Единственным приемлемым способом транспортировки синтез-газа является его транспортировка по трубопроводам.
Применение
 Получение и применение синтез-газа
Получение и применение синтез-газаПолучение аммиака
Наиболее важной областью применения синтез-газа является производство аммиака – Nh4.
Смесь азота и водорода пропускают над железным катализатором (который содержит оксид алюминия в качестве промотора). Реакция проходит в очень жестких условиях — при температуре 420 С и давлении 280 атм.
Большая часть установок по производству аммиака снабжена оборудованием для отделения СО от сырья, так как СО может отравлять катализатор. Чаще всего с этой целью СО обрабатывают водяным паром для получения СО и Н2. Диоксид углерода удаляют экстракцией этаноламином, а Н2 направляют на рециркуляцию.
Получение метанола
Метанол часто называют древесным спиртом. Это связано с тем, что первым промышленным способом получения метанола была сухая перегонка свежеспиленной древесины лиственных деревьев. Помимо других соединений в летучей фракции присутствует метанол. Отсюда и произошло название «древесный спирт».
С 1923 г. метанол производится в промышленности из синтез-газа; в настоящее время большую часть метанола получают именно таким методом. По нескольким причинам эти установки обычно строят вблизи установок для производства аммиака или даже объединяют с ними.
Технология и оборудование аналогичны, и в производстве метанола можно использовать СО2, образующийся при синтезе аммиака. В этом случае СО2 вводят в реакцию с метаном и водяным паром над никелевым катализатором, приводящую к образованию дополнительного количества СО и Н2, которые затем взаимодействуют, давая метанол.
Процесс проводят при давлении 67 – 100 атм. И температуре 200 – 260оС на катализаторах на основе оксидов меди и цинка.
Синтез Фишера-Тропша
Каталитическое гидрирование оксида углерода (синтез Фишера-Тропша) для получения углеводородов, в частности парафинов, в основном нормального строения и олефинов, является гетерогенной реакцией. Проводится она преимущественно над кобальтовыми или над железными катализаторами с использованием возможно более чистых смесей оксида углерода и водорода. Оптимальные рабочие температуры синтеза различны для различных катализаторов.
Никелевые и кобальтовые катализаторы дают оптимальные результаты при 170-205, железные — при 200-325°С. Синтез на никелевых катализаторах ведется практически только при нормальном давлении, так как при повышенном давлении резко усиливается образование карбонилов.
На железном и кобальтовом катализаторах можно работать без образования карбонилов при давлениях до 20 атм.
Считается, что при синтезе по Фишеру-Тропшу на железных катализаторах оксид углерода гидрируется с образование метиленовой группа, которая затем полимеризуется. Оксид углерода конвертируется в углекислоту. При этом кислород оксида углерода связывается, образуя воду. Этим реакциям благоприятствуют более высокая температура синтеза на железных катализаторах и активность железа по отношению к реакции конверсии.
С технической точки зрения решающее значение при синтезе Фишера-Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования оксида углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза. В противном случае значительно возрастает нежелательное образование метана. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации.
метана | Определение, свойства, использование и факты
Метан , бесцветный газ без запаха, который часто встречается в природе и является продуктом определенной деятельности человека. Метан — простейший член парафинового ряда углеводородов и один из самых сильных парниковых газов. Его химическая формула — CH 4 .
метановый цикл Encyclopdia Britannica, Inc.Британская викторина
Ветер и воздух: факт или вымысел?
Суперячейка — это очень большая батарея.
Химические свойства метана
Метан легче воздуха, его удельный вес составляет 0,554. Он слабо растворяется в воде. Легко горит на воздухе, образуя углекислый газ и водяной пар; пламя бледное, слегка яркое и очень горячее. Точка кипения метана составляет -162 ° C (-259,6 ° F), а точка плавления -182,5 ° C (-296,5 ° F). Метан в целом очень стабилен, но смеси метана и воздуха с содержанием метана от 5 до 14 процентов по объему взрывоопасны.Взрывы таких смесей часто случаются на угольных шахтах и угольных шахтах и являются причиной многих аварий на шахтах.
структура метана Тетраэдрическая структура метана (CH 4 ) объясняется в теории VSEPR (валентная оболочка-электронная пара отталкивания) молекулярной формы, предполагая, что четыре пары связывающих электронов (представленные серыми облаками) ) занимают позиции, минимизирующие их взаимное отталкивание. Encyclopædia Britannica, Inc.Источники метана
В природе метан образуется в результате анаэробного бактериального разложения растительного вещества под водой (где его иногда называют болотным газом или болотным газом).Водно-болотные угодья являются основным естественным источником производимого таким образом метана. Другие важные природные источники метана включают термитов (в результате процессов пищеварения), вулканы, жерла на дне океана и отложения гидрата метана, которые встречаются вдоль окраин континентов и под антарктическими льдами и арктической вечной мерзлотой. Метан также является основным компонентом природного газа, который содержит от 50 до 90 процентов метана (в зависимости от источника) и встречается как компонент горючего газа (горючего газа) вдоль угольных пластов.
химическая структура метана Тетраэдрическая геометрия метана: (A) модель стержня и шара и (B) диаграмма, показывающая валентные углы и расстояния. (Простые связи обозначают связи в плоскости изображения; клин и пунктир обозначают связи, направленные к зрителю и от него, соответственно.) Encyclopædia Britannica, Inc.Производство и сжигание природного газа и угля являются основными антропогенными факторами. (связанные с человеком) источники метана. Такие виды деятельности, как добыча и переработка природного газа и разрушающая перегонка битуминозного угля при производстве угольного и коксового газа, приводят к выбросу значительных количеств метана в атмосферу.Другая деятельность человека, связанная с производством метана, включает сжигание биомассы, животноводство и управление отходами (где бактерии производят метан, разлагая отстой в очистных сооружениях и разлагающиеся вещества на свалках).
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняИспользование метана
Метан — важный источник водорода и некоторых органических химикатов. Метан реагирует с паром при высоких температурах с образованием окиси углерода и водорода; последний используется при производстве аммиака для удобрений и взрывчатых веществ.Другие ценные химические вещества, полученные из метана, включают метанол, хлороформ, четыреххлористый углерод и нитрометан. При неполном сгорании метана образуется технический углерод, который широко используется в качестве армирующего агента в резине, используемой для автомобильных шин.
Роль как парниковый газ
Метан, который производится и выбрасывается в атмосферу, поглощается стоками метана, которые включают почву и процесс окисления метана в тропосфере (нижний уровень атмосферы).Большая часть метана, производимого естественным путем, компенсируется его поглощением в естественных стоках. Однако антропогенное производство метана может вызвать более быстрое увеличение концентрации метана, чем оно компенсируется стоками. С 2007 года концентрация метана в атмосфере Земли увеличивалась на 6,8–10 частей на миллиард (ppb) в год. К 2020 году содержание метана в атмосфере достигло 1873,5 частей на миллиард, что примерно в два-три раза выше, чем доиндустриальные уровни, которые колебались на уровне 600-700 частей на миллиард.
Повышенная концентрация метана в атмосфере способствует парниковому эффекту, в результате чего парниковые газы (особенно углекислый газ, метан и водяной пар) поглощают инфракрасное излучение (чистую тепловую энергию) и переизлучают его обратно на поверхность Земли, потенциально задерживая тепло и производя существенные изменения климата.Повышенное содержание метана в атмосфере также косвенно увеличивает парниковый эффект. Например, при окислении метана гидроксильные радикалы (OH —) удаляют метан, вступая с ним в реакцию с образованием диоксида углерода и водяного пара, а по мере увеличения концентрации атмосферного метана концентрации гидроксильных радикалов уменьшаются, эффективно продлевая время жизни метана в атмосфере .
The Editors of Encyclopaedia Britannica Эта статья была недавно отредактирована и обновлена редактором Джоном П. Рафферти.Узнайте больше в этих связанных статьях Britannica:
глобальное потепление: метан
Метан (CH 4 ) — второй по значимости парниковый газ. CH 4 более мощный, чем CO 2 , потому что радиационное воздействие, производимое на одну молекулу, больше.Кроме того, инфракрасное окно менее насыщено в диапазоне длин волн излучения, поглощаемого CH 4 , поэтому больше…
парниковый газ: метан
Метан (CH 4 ) — второй по значимости парниковый газ.CH 4 более мощный, чем CO 2 , потому что радиационное воздействие, производимое на одну молекулу, больше. Кроме того, инфракрасное окно менее насыщено в диапазоне длин волн излучения, поглощаемого CH 4 , поэтому больше…
Климат: Климат и жизнь
… пар, двуокись углерода, окись углерода, метан, озон, двуокись азота, азотная кислота, аммиак и ионы аммония, закись азота, двуокись серы, сероводород, сульфид карбонила, диметилсульфид и сложный набор неметановых углеводородов.Из них…
природного газа | Определение, открытие, запасы и факты
Природный газ , бесцветный легковоспламеняющийся газообразный углеводород, состоящий в основном из метана и этана. Это тип нефти, которая обычно встречается вместе с сырой нефтью. В качестве ископаемого топлива природный газ используется для производства электроэнергии, отопления и приготовления пищи, а также в качестве топлива для некоторых транспортных средств. Он важен в качестве химического сырья при производстве пластмасс и необходим для широкого спектра других химических продуктов, включая удобрения и красители.
The Troll Платформа для добычи природного газа в Северном море, в 80 км (50 миль) к северо-западу от Бергена, Норвегия. Тролль А, самая большая из когда-либо построенных передвижных конструкций, покоится на морском дне на глубине примерно 300 метров (990 футов) от поверхности и возвышается более чем на 100 метров (330 футов) над уровнем моря. Платформа регулирует добычу газа из 40 скважин, расположенных на морском дне. Swinsto101Британская викторина
Нефть и природный газ: факт или вымысел?
Природный газ не имеет запаха.
Природный газ часто растворяется в нефти при высоком давлении, существующем в коллекторе, и может присутствовать в виде газовой шапки над нефтью. Во многих случаях именно давление природного газа, оказываемое на подземный нефтяной пласт, является движущей силой для выталкивания нефти на поверхность. Такой природный газ известен как попутный газ; он часто считается газовой фазой сырой нефти и обычно содержит легкие жидкости, такие как пропан и бутан.По этой причине попутный газ иногда называют «влажным газом». Есть также резервуары, которые содержат газ и не содержат нефти. Этот газ называется несвязанным газом. Неассоциированный газ, поступающий из резервуаров, не связанных с каким-либо известным источником жидкой нефти, называется «сухим газом».
История использования
Открытие и раннее применение
Первые открытия выходов природного газа были сделаны в Иране между 6000 и 2000 годами до нашей эры. Многие ранние авторы описывали естественные утечки нефти на Ближнем Востоке, особенно в районе Баку, который сейчас является Азербайджаном.Утечки газа, вероятно, сначала воспламененные молнией, послужили топливом для «вечных огней» огнепоклоннической религии древних персов.
Использование природного газа упоминалось в Китае около 900 г. до н. Э. Именно в Китае в 211 г. до н. Э. Была пробурена первая известная скважина для добычи природного газа на глубину 150 метров (500 футов). Китайцы пробурили свои скважины с бамбуковыми шестами и примитивными ударными долотами специально для поиска газа в известняках, относящихся к позднетриасовой эпохе (примерно с 237 миллионов до 201 г.3 миллиона лет назад) в антиклинали (арка многослойной скалы) к западу от современного Чунцина. Газ сжигали, чтобы высушить каменную соль, обнаруженную в прослоях известняка. В итоге скважины были пробурены до глубины около 1000 метров (3300 футов), и к 1900 году в антиклинали было пробурено более 1100 скважин.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняПриродный газ был неизвестен в Европе до его открытия в Англии в 1659 году, но даже тогда он не получил широкого распространения.Вместо этого газ, полученный из обугленного угля (известный как городской газ), стал основным топливом для освещения улиц и домов по всей Европе с 1790 года.
В Северной Америке первым промышленным применением нефтепродуктов стало использование природного газа из неглубокой скважины в Фредонии, штат Нью-Йорк, в 1821 году. Газ распределялся по свинцовой трубе малого диаметра к потребителям для освещения и приготовления пищи.
Реконструкция газопроводов
На протяжении 19 века использование природного газа оставалось ограниченным, поскольку не было возможности транспортировать большие объемы газа на большие расстояния.Природный газ оставался на обочине промышленного развития, основанного в основном на угле и нефти. Важный прорыв в газотранспортной технике произошел в 1890 году с изобретением герметичной муфты трубопроводов. Тем не менее, материалы и методы строительства оставались настолько громоздкими, что газ нельзя было использовать на расстоянии более 160 км (100 миль) от источника подачи. Таким образом, попутный газ в основном сжигался на факеле (то есть сжигался на устье скважины), а несвязанный газ оставался в земле, а городской газ производился для использования в городах.
Передача газа на большие расстояния стала практикой в конце 1920-х годов благодаря дальнейшему развитию трубопроводных технологий. С 1927 по 1931 год в США было построено более 10 основных систем передачи. Каждая из этих систем была оборудована трубами диаметром примерно 50 см (20 дюймов) и протяженностью более 320 км (200 миль). После Второй мировой войны было построено большое количество трубопроводов еще большей длины с увеличивающимся диаметром. Стало возможным изготовление труб диаметром до 150 см (60 дюймов).С начала 1970-х годов самые длинные газопроводы берут свое начало в России. Например, в 1960-х и 1970-х годах трубопровод «Северное сияние» протяженностью 5470 км (3400 миль) был построен через Уральские горы и около 700 рек и ручьев, связав Восточную Европу с западносибирскими газовыми месторождениями за Полярным кругом. . В результате газ с Уренгойского месторождения, крупнейшего в мире, в настоящее время транспортируется в Восточную Европу, а затем в Западную Европу для потребления. Другой газопровод, более короткий, но также представляющий большую техническую сложность, — это Транс-Средиземноморский трубопровод длиной 50 см (20 дюймов), который в 1970–1980-х годах был построен между Алжиром и Сицилией.На некоторых участках этого маршрута глубина моря превышает 600 метров (2000 футов).
Темане, Мозамбик: трубопровод природного газа Трубопровод природного газа в Темане, Мозамбик. SasolПриродный газ как топливо премиум-класса
Еще в 1960 году попутный газ являлся нежелательным побочным продуктом добычи нефти во многих регионах мира. Газ отделяли от потока сырой нефти и удаляли как можно дешевле, часто сжигая его на факеле. Только после нехватки сырой нефти в конце 1960-х — начале 1970-х годов природный газ стал важным мировым источником энергии ( см. нефтяной кризис).
Даже в Соединенных Штатах рынок отопления домов природным газом был ограничен до 1930-х годов, когда городской газ начал заменяться обильными и более дешевыми запасами природного газа, теплотворная способность которого в два раза превышала его синтетический предшественник. Кроме того, при полном сгорании природного газа обычно образуются углекислый газ и вода. Сжигание газа относительно не содержит сажи, окиси углерода и оксидов азота, связанных с сжиганием других ископаемых видов топлива. Кроме того, практически отсутствуют выбросы диоксида серы, другого крупного загрязнителя воздуха.Как следствие, природный газ часто является предпочтительным топливом по экологическим причинам, и он вытесняет уголь в качестве топлива для электростанций во многих частях мира.
.