Карбоновые плавления — Справочник химика 21
Чтобы установить соотношение обоих изомерных бромидов, снимают диаграмму плавкости смесей чистых анилидов изомерных карбоновых кислот (анилидов изокапроновых кислот), устанавливают температуру плавления смеси анилидов неизвестного состава и фиксируют ее положение на диаграмме плавкости. После этого соотношение обоих изомерных бромидов в смеси можно отсчитать на диаграмме. По Хассу и Веберу таким же образом можно определить соотношение 2- и, -хлорпентана [34] [c.543]Водородная связь объясняет аномально высокие температуры кипения и плавления ряда веществ, аномальную диэлектрическую проницаемость и не соответствующую строению молекул растворимость. Так, способность спиртов, аминов, карбоновых кислот растворяться в значительной степени обусловлена наличием водородной связи. Эта же связь приводит к ассоциации молекул. На , пример, при ассоциации молекул спирта образуются димеры, три-меры и т.

Такое своеобразное различие между карбоновыми кислотами с четным и нечетным числом атомов углерода проявляется не только в температурах плавления, но отчасти и в химических, а также в биологических свойствах. Так, например, кислотй с четным числом углеродных атомов распадаются при кровоизлиянии печени до ацетона (Эмбден), в то время как нечетные — не распадаются аналогичные колебания на- [c.242]
Так как индоксил (стр. 696) получается путем щелочного плавления фенилглицин-о-карбоновой кислоты в промышленных масштабах и его восстановление в индол не представляет трудностей, то в настоящее время этот метод получения индола, по-видимо.му, стоит на первом месте. [c.987]
Для доказательства структуры (IV) была синтезирована описанная в литературе 13] дибензил-о-карбоновая кислота. Смешанная проба обоих веществ депрессии температуры плавления не дала. [c.46]
Следует отметить, что карбоновые кислоты по сравнению, например, со спиртами (с тем же числом углеродных атомов) имеют довольно высокие температуры кипения и плавления. Это можно объяснить значительной ассоциацией молекул кислот за счет более прочных, чем в спиртах, водородных связей (связь О—Н в кислотах более поляризована), которые образуются при взаимодействии [c.142]
Это можно объяснить значительной ассоциацией молекул кислот за счет более прочных, чем в спиртах, водородных связей (связь О—Н в кислотах более поляризована), которые образуются при взаимодействии [c.142]
Одноосновные оксикислоты с небольшой молекулярной массой представляют собой сиропообразные жидкости или твердые вещества. Двухосновные оксикислоты — твердые кристаллические соединения, растворимость которых в воде выше, чем соответствующих карбоновых кислот. Они отличаются от карбоновых кислот с тем же числом углеродных атомов более высокими температурами плавления и кипения. Оксикислоты — более кислые соединения [c.213]
Объясните, почему карбоновые кислоты имеют аномально высокие температуры кипения и плавления. [c.67]
Образование достаточно прочных водородных связей обуславливает высокие температуры кипения и плавления карбоновых кислот, а также высокую растворимость в воде. В воде карбоновые кислоты сольватированы [c. 350]
350]
Водородная связь между атомами А и В двух различных молекул — межмолекулярная водородная связь — приводит к ассоциации молекул, проявляется в аномально высоких температурах кипения, плавления и других свойствах образовавшихся веществ. Из примеров таких соединений приведем схемы (НгО)п, (НР) , (К Н.ч)п, карбоновых кислот и спиртов [c.127]
Вследствие неполярности или малой полярности ковалентных связей в органических соединениях силы межмолекулярного взаимодействия в них слабы, чем объясняется их низкая температура плавления и кипения. Из-за этого же органические соединения преимущественно нерастворимы в воде. Из немногих растворимых в воде лишь некоторые слабо диссоциируют на ионы (например, карбоновые кислоты). Поэтому водные растворы органических веществ плохо проводят электрический ток. [c.369]
Свободные сульфокислоты в большинстве случаев не имеют характеристических температур плавления все они значительно более сильные кислоты, чем карбоновые, [c. 561]
561]
Аминокислоты можно охарактеризовать теми же методами, чтО амины и карбоновые кислоты. Более пригодными оказываются производные, полученные реакциями по аминогруппе. Аминокислоты нельзя идентифицировать по температурам плавления при нагревании они разлагаются, причем температуры разложения не характеристичны.
Полученная 2,3-дигидробензофуран-2-карбоновая ки- слота вполне пригодна как исходный продукт для дальнейших синтезов. После перекристаллизации из 50%-ной уксусной кислоты температура плавления не изменяется. Кислоту можно перегнать при уменьшенном давлении т. кип. [c.16]
Для выделения свободной бифенил-4-карбоновой кислоты 31 от осадок (кальциевая соль названной кислоты) медленно вносят при размешивании в 1200 мл концентрированной соляной кислоты, нагревают до кипения и выдерживают до полного перехода соли в кислоту, что определяют по температуре плавления пробы. [c.72]
Соли карбоновых кислот, как и все соли, представляют собой кристаллические нелетучие вещества, состоящие из положительно и отрицательно заряженных ионов, и их свойства вполне соответствуют тому, что можно было ожидать для подобной структуры. Сильные электростатические силы, удерживающие ионы в кристаллической решетке, могут быть преодолены лишь путем нагревания до высокой температуры или использования очень полярного растворителя. Температура, необходимая для плавления, оказывается столь высокой, что еще до того, как она может быть достигнута, рвутся связи углерод — углерод и молекула разрушается обычно при температуре 300—400 °С. Температура разложения редко может быть использована для идентификации соединения, поскольку она скорее зависит от скорости нагревания, чем от свойств соединения. [c.555]
Сильные электростатические силы, удерживающие ионы в кристаллической решетке, могут быть преодолены лишь путем нагревания до высокой температуры или использования очень полярного растворителя. Температура, необходимая для плавления, оказывается столь высокой, что еще до того, как она может быть достигнута, рвутся связи углерод — углерод и молекула разрушается обычно при температуре 300—400 °С. Температура разложения редко может быть использована для идентификации соединения, поскольку она скорее зависит от скорости нагревания, чем от свойств соединения. [c.555]
В разд. 18.4 мы отметили резкое различие в физических свойствах карбоновых кислот и их солей то же различие наблюдается при сопоставлении свойств аминов и их солей. Соли аминов — типичные ионные соединения. Они представляют собой нелетучие твердые вещества с высокой температурой плавления и при нагревании разлагаются обычно ииже температуры плавления. Галогениды, нитраты и сулы )аты растворимы в воде, но не растворимы в неполярных растворителях.
Аналогичные соотношения имеются и в некоторых других гомологических рядах, например в ряду карбоновых кислот. Разделение этих рядов на группы соединений с четным и нечетным числом атомов углерода находит свое отражение не только в температурах плавления, но и во многих, других свойствах, например физиологическом действии, константах диссоциации и т. д. Подобное колебание свойств внутри одного гомологического ряда, по-видимому, обусловлено особенностями строения молекул членов рядЬ с четным и нечетным числом углеродных атомов. [c.36]
Из этого следует, что для выяснения положеиня двойной связи в ненасыщенных карбоновых кислотах можно применять лишь такие реакции, для которых доказано, что они не сопровождаются перемещением двойных связей. Так, например, нельзя пользоваться применявшимся ранее для этой цели щелочным плавлением (три котором молекула ненасыщ( нной кислоты разрывается на отдельн1ле части), так как при этом ненасыщенные кислоты, независимо от положения в них этиленовой связи, обычно расщепляются между а- и 3-а омами углерода.
Второй метод синтеза индиго, применявшийся одно время в промышленности, тоже был предложен Гейманом впоследствии он был уточнен и доработан Баденской анилиновой фабрикой. Исходным материалом для этого синтеза служит антраниловая кислота, которая может быть легко и дешево получена из нафта.пииа через фталевую кислоту и фталимид (стр. 653). Ее конденсируют с хлоруксусной кислотой и образующуюся фенилглицин-о-карбоновую кислоту подвергают щелочному плавлению. При этом с количественным выходом получается индоксиловая кислота, которая, отщепляя углекислоту, превращается в индоксил. Последняя стадия этого процесса тоже за-[окислении индоксила до индиго
Совместной поликонденсацией многоосновных карбоновых кислот с многоатомными спиртами или диаминами, а также совместной поликонденсацней различных оксикислот или аминокислот можно широко варьировать свойства гетероцепных полимерных сложных эфиров и полиамидов.
 В результате реакций совместной полиэтерификации или полиамидирования, в которых принимают участие различные дикарбоновые кислоты и различные диолы или диамины, изменяется концентрация полярных групп пли регулярность их расположения в макромолекулах полимера, что отражается на его физических и механических свойствах. С понижением концентрации полярных групп в макромолекулах уменьшается количество водородных связей между цепями и, следовательно, снижается температура плавления и твердость полимера, возрастает его упругость и растворимость. Нарушение регулярности чередования метиленовых (или фениленовых) и полярных групп. штрудняет процесс кристаллизации сополимера и снижает степень его кристалличности. Это придает сополимеру большую эластичность, по вызывает уменьшение прочности и теплостойкости изделий из данного полимерного материала. При поликонденсации ш-амино-капроновой кислоты с небольшим постепенно возрастаюш,им количеством АГ-соли (соль гексаметилендиамипа и адипиновой кислоты, или соль 6-6) температура размягчения сополимера плавно снижается.
В результате реакций совместной полиэтерификации или полиамидирования, в которых принимают участие различные дикарбоновые кислоты и различные диолы или диамины, изменяется концентрация полярных групп пли регулярность их расположения в макромолекулах полимера, что отражается на его физических и механических свойствах. С понижением концентрации полярных групп в макромолекулах уменьшается количество водородных связей между цепями и, следовательно, снижается температура плавления и твердость полимера, возрастает его упругость и растворимость. Нарушение регулярности чередования метиленовых (или фениленовых) и полярных групп. штрудняет процесс кристаллизации сополимера и снижает степень его кристалличности. Это придает сополимеру большую эластичность, по вызывает уменьшение прочности и теплостойкости изделий из данного полимерного материала. При поликонденсации ш-амино-капроновой кислоты с небольшим постепенно возрастаюш,им количеством АГ-соли (соль гексаметилендиамипа и адипиновой кислоты, или соль 6-6) температура размягчения сополимера плавно снижается. Если в макромолекулах сополимера количество звеньев соли 6-6 достигает 35—50%, температура плавления сополимера снижается до минимума (150° вместо 214—218° для полиами- [c.532]
Если в макромолекулах сополимера количество звеньев соли 6-6 достигает 35—50%, температура плавления сополимера снижается до минимума (150° вместо 214—218° для полиами- [c.532]По сравнению с алифатическими кислотами такого же молекулярного веса температуры кипения ароматических кислот немного выше, а температуры плавления гораздо выше. Бензойная кислота рКк = 4,17) является несколько более сильной кислотой, чем уксусная (р/Ск=4,74). Почти все обычные заместители, кроме аминогруппы, усиливают кислотный характер ароматических кислот особенно сильное действие оказывают заместители, находяш,иеся в орто-положении. Гидрофильные карбоксильные группы, связанные с бензольным кольцом, имеют тенденцию понижать растворимость кислот в углеводородах или в эфире и незначительно повышать растворимость в холодной воде одноосновные карбоновые кислоты лишь немного растворимы в холодной [c.342]
Структура молекулы и температура плавления (между 100— 140 С) говорят об их растворимости в ароматических углеводородах и уайт-спирите [2, 3]. Для модификации канифоли часто исиользуют низкомолекулярные алкилфенольные смолы, которые активно взаимодействуют с маслами. Эти смолы способствуют пре-вращеиию кислот, содержащихся в канифоли, в полиэфир поли-карбоновой кислоты либо через образование хроманового кольца (см. разд. 3.3.5 и 17.1), либо, что более вероятно, через алкилиро-вание, чему благоприятствует кислотность среды и наличие карбоксильной груины. Фенольную смолу добавляют к раснлавленной канифоли ири ПО—140°С в этих условиях смола должна легко растворяться, потому что в противном случае может произойти самоконденсация резола. Затем температуру повьпнают примерно до 250 °С и добавляют в систему глицерин илн иентаэритрит с целью образования сложных эфиров и повышения молекулярной массы смолы. Прн температуре выше 250 °С начинается декар-боксилирование. В некоторых случаях реакцию проводят при относительно высоких температурах с участием новолаков. Кислоты канифоли могут предварительно взаимодействовать с формальдегидом (механизм реакции Принса, см.
Для модификации канифоли часто исиользуют низкомолекулярные алкилфенольные смолы, которые активно взаимодействуют с маслами. Эти смолы способствуют пре-вращеиию кислот, содержащихся в канифоли, в полиэфир поли-карбоновой кислоты либо через образование хроманового кольца (см. разд. 3.3.5 и 17.1), либо, что более вероятно, через алкилиро-вание, чему благоприятствует кислотность среды и наличие карбоксильной груины. Фенольную смолу добавляют к раснлавленной канифоли ири ПО—140°С в этих условиях смола должна легко растворяться, потому что в противном случае может произойти самоконденсация резола. Затем температуру повьпнают примерно до 250 °С и добавляют в систему глицерин илн иентаэритрит с целью образования сложных эфиров и повышения молекулярной массы смолы. Прн температуре выше 250 °С начинается декар-боксилирование. В некоторых случаях реакцию проводят при относительно высоких температурах с участием новолаков. Кислоты канифоли могут предварительно взаимодействовать с формальдегидом (механизм реакции Принса, см. разд. 2.17), образуя соединения, содержащие гидроксильные группы в таких случаях интервал температур размягчения канифоли поднимается примерно с 45 до 105 °С. Прн температурах выше 125 °С в систему рекомендуют медленно добавлять ангидрид малеиновой кислоты (механизм реакцпи 1,4-присоедииения сопряженных диенов) [c.206]
разд. 2.17), образуя соединения, содержащие гидроксильные группы в таких случаях интервал температур размягчения канифоли поднимается примерно с 45 до 105 °С. Прн температурах выше 125 °С в систему рекомендуют медленно добавлять ангидрид малеиновой кислоты (механизм реакцпи 1,4-присоедииения сопряженных диенов) [c.206]
Охарактеризовать сульфокислоты удается лишь через некоторые кристаллические производные. Для идентификации сульфокислот могут быть использованы многие методы, применимые для идентификации карбоновых кислот, но обш,его метода идентификации сульфокислот не существует. Наиболее удобными производными для идентификации сульфокислот являются их амиды и анилиды — легко кристаллизующиеся вещества, обладающие резкой температурой плавления. К сожалению, получение этих производных требует много времени, так как осуществляется через хлорангидриды, синтез которых иногда сопряжен с трудностями из-за неустойчивости сульфохлоридов или вследствие чувствительности некоторых групп (ОН, МНа и др. ) к действию хлорангидризующих средств. Однако часто сульфохлориды (в отличие от хлорангидридов карбоновых кислот) являются вполне устойчивыми веществами с четкой температурой плавления. Значительно реже для идентификации сульфокислот пользуются их кристаллическими эфирами (феииловые и В-нафтиловые эфиры сульфокислот). [c.304]
) к действию хлорангидризующих средств. Однако часто сульфохлориды (в отличие от хлорангидридов карбоновых кислот) являются вполне устойчивыми веществами с четкой температурой плавления. Значительно реже для идентификации сульфокислот пользуются их кристаллическими эфирами (феииловые и В-нафтиловые эфиры сульфокислот). [c.304]
Эфирный слой (I), из которого удалена карбоновая или сульфокислота, экстрагируют 2 н. соляной кислотой, отделяют водный слой (оставшийся эфирный раствор П сохраняют) и подщ,елачи-вают его 2 н. раствором едкого натра. Если при этом выделяется масло или кристаллическое вещество, его дважды извлекают эфиром и высушивают экстракт плавленым сульфатом натрия в течение 10 мин. Остаток после испарения эфира на водяной бане должен быть веществом, обладающим основными свойствами. [c.243]
S) 2-Циантиофен (70% из альдегида тиофен-2-карбоновой кислоты и 4-амино-1,2,4-триазола, нагреваемых в бензоле со следами й-толуолсульфокислоты, с последующим нагреванием образующегося азометина выше температуры его плавления) [62]. [c.452]
[c.452]
Необходимую информацию дает также прокаливание. Для этого на крышку тигля помещают 0,1 мл жидкого или на кончик шпателя 0,01 г твердого вещества и вносят крышку или шпатель в верхнюю или боковую часть бесцветного пламени горелки, постепенно передвигая нх в более горячую часть. Внимательно наблюдают за происходящими превращеинями и записывают характер плавления с разложением или без него) и горения (быстрое или медленное, со вспышкой или без нее), отмечают также цвет пламени и запах продуктов горения. Если вещество горит почти голубым пламенем, то в нем присутствуют кислородсодержащие функциональные группы. Желтое светящееся (коптящее) пламя характерно для веществ, богатых углеродом (ароматические и ацетиленовые углеводороды). Отмечают также, полностью сгорает вещество или иет. В последнем случае вещество может представлять собой соль органической кислоты (карбоновой, сульфо- и т. д.). Окраска пламени может указать иа природу катиона. [c.94]
Образование амидов при взаимодействии первичных или вторичных аминов с карбоновыми кислотами — реакция хорошо известная в органической химии. Эта же реакиия с дифункциоиальными мономерами является удобным методом получения полиамидов и родственных им полимеров. Реакция обычно проводится при нагревании смеси мономеров при температуре более высокой, чем температура плавления получающегося полимера, и обычно с применением высокого вакуума или в токе инертного газа (иногда и то и другое), что способствует Удалению последних следов воды и тем самым увеличению степени завершенности реакции. Проведение реакции поликонденсации в расплаве ограничивается термической устойчивостью исходных мономеров и получаемого полимера. [c.79]
Эта же реакиия с дифункциоиальными мономерами является удобным методом получения полиамидов и родственных им полимеров. Реакция обычно проводится при нагревании смеси мономеров при температуре более высокой, чем температура плавления получающегося полимера, и обычно с применением высокого вакуума или в токе инертного газа (иногда и то и другое), что способствует Удалению последних следов воды и тем самым увеличению степени завершенности реакции. Проведение реакции поликонденсации в расплаве ограничивается термической устойчивостью исходных мономеров и получаемого полимера. [c.79]
Карбоновые кислоты, применяемые при получении ангидридов. Первые исследования с хлорист >1М ацетилом и хлористым бензоилом [172, 176] показали, что смешанный ангидрид с бензойной кислотой приводит к меньшему диспропорционированию, чем смешанный ангидрид с уксусной кислотой. При систематическом изучении были п6луч1екы смешанные ангидриды карбобензилоксиглицина и большого числа карбоновых кислот, их подвергли реакции с анилином, причем были определены вы-температура плавления полученных продуктов. Реакции проводились в безводной среде, поэтому можно было сравнить полученные результаты е предсказаниями Эмври и Голда [3, 4,] [c.213]
Реакции проводились в безводной среде, поэтому можно было сравнить полученные результаты е предсказаниями Эмври и Голда [3, 4,] [c.213]
А. амфотерны реагируя с минер, к-тами, образуют на-фтоламмониевые соли, с едкими щелочами-нафтоляты. Окисляются на воздухе, особенно легко в щелочных р-рах, причем р-ры окрашиваются. А., содержащие группы ОН и Nh3 в одном кольце, при окислении превращ. в нафтохи-ноны. А., у к-рых группы Nh3 и ОН находятся в разных кольцах, могут вступать с солями диазония в азосочетание при этом в кислой среде проявляется ориентирующее влияние аминогруппы, в щелочной-гидроксильной. Азосочетанием сначала в кислой среде, а затем в щелочной получают дисазосоединения. При взаимод. с ангидридами или хлорангидридами карбоновых к-т А. превращаются в N-ацил-аминонафтолы, обладающие четкими т-рами плавления, что используют для идентификации А. [c.141]
Для получения высших жирных к-т используют гидролиз животных жиров и растит масел, для получения (в-галоген-карбоновых к-т гидролиз трихлорметильиой группы продуктов теломеризации олефинов и ССЦ. Применяется также щелочное плавление спиртов, получаемьи оксосинтезом (до С.о) [c.327]
Применяется также щелочное плавление спиртов, получаемьи оксосинтезом (до С.о) [c.327]
Метиламид бензофуран-2-карбоновой кислоты можно перекристаллизовать из абсолютного бензола после перекристаллизации температура плавления повышается до 106 — 107°. Однако полученный описанным выше способом продукт достаточно чист и без дальнейшей перекристаллизации может быть восстановлен в бензофурфурилметиламин. [c.25]
Бензилтетрагидрофуран-2-карбоновая кислота при стоянии иногда кристаллизуется с непостоянной температурой плавления, так как представляет собой смесь двух пространственных изомеров она может быть использована для дальнейших стадий синтеза. [c.30]
Чистая 4-нитро-4 -метоксидифениламин-2-карбоновая кислота (выход 58—60% от теоретического) имеет температуру плавления 230—231° смешанная проба с образцом этой кислоты, полученным по Леснянскому [4], плавится без депрессии. [c.76]
Чистая 4-1Гитро-2 -мегоксидифениламин-2-карбоновая кислота кристаллизуется в виде ярко-желтых игл с температурой плавления 215°.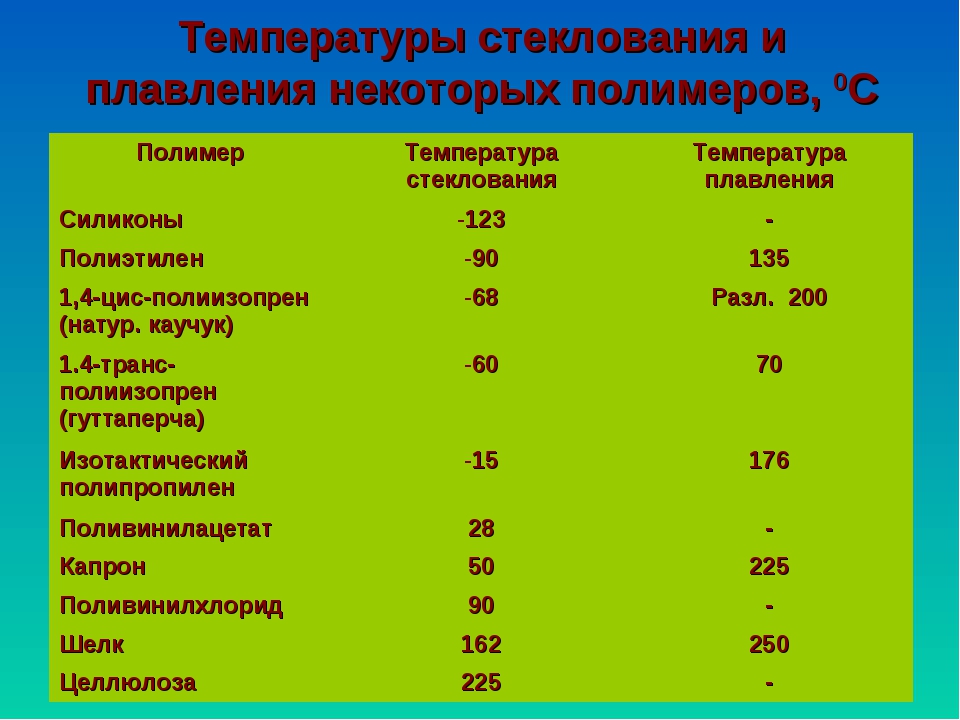 Выход ее составляет около 50%, считая на 2-хлор-5-нитробензойную кислоту. [c.77]
Выход ее составляет около 50%, считая на 2-хлор-5-нитробензойную кислоту. [c.77]
Аналогичным путем из 22,5 г 4-нитро-2 -метоксидифенил-амин-2-карбоновой кислоты, 50 г хлорокиси фосфора и 180 мл -ксилола получают 23,4 г чистого 4-метокси-7-нитро-9-хлор-акридина с температурой плавления 267—267,5°. [c.80]
Так же как силы различного рода способны удерживать атомы в молекуле, имеется много различных типов сил, связывающих вместе молекулы в конденсированном состоянии материи. Они включают и относительно слабые силы, являющиеся следствием дисперсионного эффекта, и мощные силы взаимодействия между ионами. Прямое электростатическое взаимодействие диполей играет важную роль в определении устойчивости твердых тел, образованных из полярных молекул, вроде воды, хлористого водорода, карбоновых кислот, спиртов и амипов. Так, замещение одного из атомов водорода метильпой группы в уксусной кислоте аминогруппой приводит к повышению точки плавления от 289,66 до 508° К это заставляет думать, что молекулярной единицей [c. 489]
489]
Ученые выяснили, что происходит с графеном при плавлении
Несмотря на широкое применение графита в самых различных сферах, где имеют место сверхвысокие температуры, детали процесса его плавления до последнего времени оставались неясными. Практически неисследованным был и процесс плавления графена.
Ученые из Московского физико-технического института и Института физики высоких давлений им. Л.Ф. Верещагина РАН с помощью компьютерного моделирования построили кривые плавления этих важных для промышленности и инновационных технологий материалов.
Графит — минерал, активно используемый в различных видах производств, в том числе в металлургии и для тепловой защиты космических аппаратов, поэтому точные сведения о его поведении при сверхвысоких температурах очень важны. Плавление графита начали изучать еще в начале ХХ века. Около сотни экспериментальных работ в качестве температуры плавления называли цифры в диапазоне от 3000 до 7000 градусов Кельвина. Понятно, что при таком огромном разбросе результаты экспериментов не вызывали доверия. Самые разные значения температур плавления давали и компьютерные модели.
Понятно, что при таком огромном разбросе результаты экспериментов не вызывали доверия. Самые разные значения температур плавления давали и компьютерные модели.
Идея авторов исследования, Юрия Фомина и Вадима Бражкина заключалась в том, чтобы сравнить результаты нескольких компьютерных моделей, построенных с помощью двух различных методов: классической молекулярной динамики и первопринципных расчетов, учитывающих квантово-механические эффекты.
Дело в том, что первый метод дает неточности из-за неучета квантовой механики, а второй — из-за того, что учитывает взаимодействие только небольшого количества атомов и на коротком промежутке времени. Сравнение результатов, полученных из разных теоретических моделей, позволило авторам найти объяснение экспериментальным результатам.
Еще в 1960-е годы было предсказано, что на кривой плавления графита должен существовать максимум — структурный переход, в котором происходит плавное изменение структуры. Потом существование этого структурного перехода то подтверждали, то опровергали. Результаты Фомина и Бражкина показывают, что структура жидкого углерода над кривой плавления графита претерпевает изменения, а значит, максимум существует.
Потом существование этого структурного перехода то подтверждали, то опровергали. Результаты Фомина и Бражкина показывают, что структура жидкого углерода над кривой плавления графита претерпевает изменения, а значит, максимум существует.
Вторая часть работы была посвящена исследованию процесса плавления графена. Экспериментов по плавлению графена нет. Компьютерные модели дают температуру плавления от 4500 до 4900 градусов Кельвина.
Расчеты авторов исследования показывают, что температура плавления графена в атмосфере аргона близка к температуре плавления графита, но сам процесс имеет одну особенность.
«В нашей работе мы обратили внимание на то, что «плавление» графена происходит неким странным образом — посредством образования линейных цепочек. Мы показали, что на самом деле там наблюдается не плавление, а переход сразу в газообразное состояние — возгонка», — приводятся в пресс-релизе института слова Юрия Фомина, доцента кафедры общей физики МФТИ.

Результаты исследования позволяют лучше понять природу фазовых переходов в углеродных наноматериалах, которые рассматриваются как важные составные части многих разрабатываемых технологий — от электроники до медицины.
Работа выполнена при поддержке Российского научного фонда с использованием вычислительных ресурсов федерального центра коллективного пользования «Комплекс моделирования и обработки данных исследовательских установок мега-класса» в НИЦ «Курчатовский институт».
ученые нашли дешевый способ сделать карбон огнеупорным
Исследователи создали особое покрытие для углеродного волокна из поваренной соли с добавлением титана и хрома.
Обладая невероятной легкостью, жесткостью и прочностью, углеродное волокно имеет много преимуществ, но даже у таких замечательных материалов есть свои недостатки. Ученые пытались решить проблему воспламенения углеродного волокна к при высоких температурах, и международная группа исследователей нашла недорогое и масштабируемое решение в виде защитного покрытия из обычной поваренной соли.
Ученые пытались решить проблему воспламенения углеродного волокна к при высоких температурах, и международная группа исследователей нашла недорогое и масштабируемое решение в виде защитного покрытия из обычной поваренной соли.
ФОКУС в Google Новостях.
Подпишись — и всегда будь в курсе событий.
Об этом сообщает издание Proceedings of the National Academy of Sciences.
Углепластик обладает высокой термостойкостью и способен сохранять стабильность при температуре до 800 °C. Это делает его незаменимым при конструировании любых видов электротранспорта, производстве медицинского оборудования и смарт-техники. Однако проблемы могут возникнуть в случае воздействия экстремальных температур (например, в аэрокосмической промышленности). В таких условиях карбон вступает в реакцию с кислородом и горит, в результате чего его структура быстро разрушается.
«Одним из недостатков углеродных волокон является то, что они легко сгорают, если у вас достаточно высокая температура и кислород в больших количествах», — говорит Юнфэн Лу, возглавлявший команду, состоящую из исследователей из Университета Небраски-Линкольна и Французского института химии конденсированных сред (Бордо). «Если бы мы могли сделать их огнеупорными, это было бы здорово».
«Если бы мы могли сделать их огнеупорными, это было бы здорово».
Ученые и раньше занимались разработкой более огнестойких форм углеродного волокна, но для этого требовалось дорогостоящее оборудование. Авторы данного исследования придумали простое и дешевое решение, в основе которого — расплавленная соль.
Процесс плавления происходит при температуре 982°C. После того, как кристаллы соли превращаются в жидкость, в смесь добавляют порошки титана и хрома, прежде чем в качестве последнего штриха будут добавлены углеродные волокна. Вступая в реакцию, все выше перечисленные компоненты образуют защитное покрытие из трех слоев.
Характеристики защитного материала были оценены в ходе экспериментов, когда карбон поджигали кислородно-ацетиленовой горелкой (1200°C) и при этом углеродные волокна успешно сохраняли свою структуру. Ученые обнаружили, что тройное покрытие, состоящее из карбида хрома и карбида титана, обеспечивает большую защиту, чем однослойное.
Ученые обнаружили, что тройное покрытие, состоящее из карбида хрома и карбида титана, обеспечивает большую защиту, чем однослойное.
«Мы пытаемся добавить поверхностные слои, которые могут отделить углеродные волокна от кислорода, чтобы даже при высоких температурах они не сгорели», — говорит Лу. «Углепластик используются в авиа- и автопроме, с области строительства, производства разного рода электроники, поэтому данный материал должен быть максимально безопасным. Но если он будет легковоспламеняющимся, это создаст огромные риски и сильно ограничит его применения».
Ученые считают, что их метод защиты карбона достаточно хорош. В будущем они намерены выяснить, насколько огнестойкими являются углеродные волокна с покрытием по сравнению с обычными, и как долго они сохраняют свою структуру и свойства в экстремальных условиях.
Ранее мы сообщали о том, что разработан метод быстрого превращения углерода в графен или алмаз.
Материал | Коэффициент линейного теплового расширения | |
10-6 °С-1 | 10-6 °F-1 | |
| ABS (акрилонитрил-бутадиен-стирол) термопласт | 73. 8 8 | 41 |
| ABS — стекло, армированное волокнами | 30.4 | 17 |
| Акриловый материал, прессованный | 234 | 130 |
| Алмаз | 1.1 | 0.6 |
| Алмаз технический | 1.2 | 0.67 |
| Алюминий | 22.2 | 12.3 |
| Ацеталь | 106.5 | 59.2 |
| Ацеталь , армированный стекловолокном | 39.4 | 22 |
| Ацетат целлюлозы (CA) | 130 | 72.2 |
| Ацетат бутират целлюлозы (CAB) | 25.2 | 14 |
| Барий | 20.6 | 11.4 |
| Бериллий | 11.5 | 6.4 |
| Бериллиево-медный сплав (Cu 75, Be 25) | 16.7 | 9.3 |
| Бетон | 14.5 | 8.0 |
| Бетонные структуры | 9.8 | 5.5 |
| Бронза | 18.0 | 10.0 |
| Ванадий | 8 | 4. 5 5 |
| Висмут | 13 | 7.3 |
| Вольфрам | 4.3 | 2.4 |
| Гадолиний | 9 | 5 |
| Гафний | 5.9 | 3.3 |
| Германий | 6.1 | 3.4 |
| Гольмий | 11.2 | 6.2 |
| Гранит | 7.9 | 4.4 |
| Графит, чистый | 7.9 | 4.4 |
| Диспрозий | 9.9 | 5.5 |
| Древесина, пихта, ель | 3.7 | 2.1 |
| Древесина дуба, параллельно волокнам | 4.9 | 2.7 |
| Древесина дуба , перпендикулярно волокнам | 5.4 | 3.0 |
| Древесина, сосна | 5 | 2.8 |
| Европий | 35 | 19.4 |
| Железо, чистое | 12.0 | 6.7 |
| Железо, литое | 10.4 | 5.9 |
| Железо, кованое | 11.3 | 6.3 |
| Золото | 14. 2 2 | 8.2 |
| Известняк | 8 | 4.4 |
| Инвар (сплав железа с никелем) | 1.5 | 0.8 |
| Инконель (сплав) | 12.6 | 7.0 |
| Иридий | 6.4 | 3.6 |
| Иттербий | 26.3 | 14.6 |
| Иттрий | 10.6 | 5.9 |
| Кадмий | 30 | 16.8 |
| Калий | 83 | 46.1 — 46.4 |
| Кальций | 22.3 | 12.4 |
| Каменная кладка | 4.7 — 9.0 | 2.6 — 5.0 |
| Каучук, твердый | 77 | 42.8 |
| Кварц | 0.77 — 1.4 | 0.43 — 0.79 |
| Керамическая плитка (черепица) | 5.9 | 3.3 |
| Кирпич | 5.5 | 3.1 |
| Кобальт | 12 | 6.7 |
| Констанан (сплав) | 18.8 | 10.4 |
| Корунд, спеченный | 6..png) 5 5 | 3.6 |
| Кремний | 5.1 | 2.8 |
| Лантан | 12.1 | 6.7 |
| Латунь | 18.7 | 10.4 |
| Лед | 51 | 28.3 |
| Литий | 46 | 25.6 |
| Литая стальная решетка | 10.8 | 6.0 |
| Лютеций | 9.9 | 5.5 |
| Литой лист из акрилового пластика | 81 | 45 |
| Магний | 25 | 14 |
| Марганец | 22 | 12.3 |
| Медноникелевый сплав 30% | 16.2 | 9 |
| Медь | 16.6 | 9.3 |
| Молибден | 5 | 2.8 |
| Монель-металл (никелево-медный сплав) | 13.5 | 7.5 |
| Мрамор | 5.5 — 14.1 | 3.1 — 7.9 |
| Мыльный камень (стеатит) | 8.5 | 4.7 |
| Мышьяк | 4.7 | 2. 6 6 |
| Натрий | 70 | 39.1 |
| Нейлон, универсальный | 72 | 40 |
| Нейлон, Тип 11 (Type 11) | 100 | 55.6 |
| Нейлон, Тип 12 (Type 12) | 80.5 | 44.7 |
| Нейлон литой , Тип 6 (Type 6) | 85 | 47.2 |
| Нейлон, Тип 6/6 (Type 6/6), формовочный состав | 80 | 44.4 |
| Неодим | 9.6 | 5.3 |
| Никель | 13.0 | 7.2 |
| Ниобий (Columbium) | 7 | 3.9 |
| Нитрат целлюлозы (CN) | 100 | 55.6 |
| Окись алюминия | 5.4 | 3.0 |
| Олово | 23.4 | 13.0 |
| Осмий | 5 | 2.8 |
| Палладий | 11.8 | 6.6 |
| Песчаник | 11.6 | 6.5 |
| Платина | 9.0 | 5.0 |
| Плутоний | 54 | 30. 2 2 |
| Полиалломер | 91.5 | 50.8 |
| Полиамид (PA) | 110 | 61.1 |
| Поливинилхлорид (PVC) | 50.4 | 28 |
| Поливинилденфторид (PVDF) | 127.8 | 71 |
| Поликарбонат (PC) | 70.2 | 39 |
| Поликарбонат — армированный стекловолокном | 21.5 | 12 |
| Полипропилен — армированный стекловолокном | 32 | 18 |
| Полистирол (PS) | 70 | 38.9 |
| Полисульфон (PSO) | 55.8 | 31 |
| Полиуретан (PUR), жесткий | 57.6 | 32 |
| Полифенилен — армированный стекловолокном | 35.8 | 20 |
| Полифенилен (PP), ненасыщенный | 90.5 | 50.3 |
| Полиэстер | 123.5 | 69 |
| Полиэстер, армированный стекловолокном | 25 | 14 |
| Полиэтилен (PE) | 200 | 111 |
| Полиэтилен — терефталий (PET) | 59. 4 4 | 33 |
| Празеодимий | 6.7 | 3.7 |
| Припой 50 — 50 | 24.0 | 13.4 |
| Прометий | 11 | 6.1 |
| Рений | 6.7 | 3.7 |
| Родий | 8 | 4.5 |
| Рутений | 9.1 | 5.1 |
| Самарий | 12.7 | 7.1 |
| Свинец | 28.0 | 15.1 |
| Свинцово-оловянный сплав | 11.6 | 6.5 |
| Селен | 3.8 | 2.1 |
| Серебро | 19.5 | 10.7 |
| Скандий | 10.2 | 5.7 |
| Слюда | 3 | 1.7 |
| Сплав твердый (Hard alloy) K20 | 6 | 3.3 |
| Сплав хастелой (Hastelloy) C | 11.3 | 6.3 |
| Сталь | 13.0 | 7.3 |
| Сталь нержавеющая аустенитная (304) | 17.3 | 9.6 |
| Сталь нержавеющая аустенитная (310) | 14. 4 4 | 8.0 |
| Сталь нержавеющая аустенитная (316) | 16.0 | 8.9 |
| Сталь нержавеющая ферритная (410) | 9.9 | 5.5 |
| Стекло витринное (зеркальное, листовое) | 9.0 | 5.0 |
| Стекло пирекс, пирекс | 4.0 | 2.2 |
| Стекло тугоплавкое | 5.9 | 3.3 |
| Строительный (известковый) раствор | 7.3 — 13.5 | 4.1-7.5 |
| Стронций | 22.5 | 12.5 |
| Сурьма | 10.4 | 5.8 |
| Таллий | 29.9 | 16.6 |
| Тантал | 6.5 | 3.6 |
| Теллур | 36.9 | 20.5 |
| Тербий | 10.3 | 5.7 |
| Титан | 8.6 | 4.8 |
| Торий | 12 | 6.7 |
| Тулий | 13.3 | 7.4 |
| Уран | 13.9 | 7.7 |
| Фарфор | 3. 6-4.5 6-4.5 | 2.0-2.5 |
| Фенольно-альдегидный полимер без добавок | 80 | 44.4 |
| Фторэтилен пропилен (FEP) | 135 | 75 |
| Хлорированный поливинилхлорид (CPVC) | 66.6 | 37 |
| Хром | 6.2 | 3.4 |
| Цемент | 10.0 | 6.0 |
| Церий | 5.2 | 2.9 |
| Цинк | 29.7 | 16.5 |
| Цирконий | 5.7 | 3.2 |
| Шифер | 10.4 | 5.8 |
| Штукатурка | 16.4 | 9.2 |
| Эбонит | 76.6 | 42.8 |
| Эпоксидная смола , литая резина и незаполненные продукты из них | 55 | 31 |
| Эрбий | 12.2 | 6.8 |
| Этилен винилацетат (EVA) | 180 | 100 |
| Этилен и этилакрилат (EEA) | 205 | 113.9 |
Эфир виниловый | 16 — 22 | 8. 7 — 12 7 — 12 |
Физические свойства карбоновых кислот | Химия онлайн
Низшие насыщенные карбоновые кислоты (С1-С3) при обычных условиях представляют собой легкоподвижные жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Кислоты состава С4-С9 – вязкие маслянистые жидкости с неприятным запахом, напоминающим запах пота, плохо растворимые в воде (разветвленные кислоты до С13 — жидкости). Высшие карбоновые кислоты (с С10) — твердые вещества, без запаха, нерастворимые в воде.
Алифатические карбоновые кислоты с количеством атомов углерода более 10 относят к высшим жирным кислотам (ВЖК), так как подавляющее большинство из них могут быть выделены из жиров животного или растительного происхождения.
Ненасыщенные кислоты при комнатной температуре – жидкости. Все дикарбоновые и ароматические кислоты при комнатной температуре – кристаллические вещества.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях. С увеличением молекулярной массы кислот растворимость в воде уменьшается. Высшие карбоновые кислоты, например, пальмитиновая С15Н31СООН и стеариновая С17Н35СООН – бесцветные твердые вещества, не растворимые в воде.
Монокарбоновые кислоты хорошо растворяются также во многих органических растворителях.
С увеличением числа атомов углерода в молекулах кислот и соответственно, с ростом относительной молекулярной массы температура кипения увеличивается, запах ослабевает и исчезает.
Температуры плавления кислот с четным числом углеродных атомов имеют более высокие температуры плавления, чем с нечетным числом. С увеличением числа углеродных атомов в молекуле кислоты температура плавления уменьшается и где-то после С25 практически сходит на нет.
При одной и той же длине углеводородного радикала температуры плавления и кипения ненасыщенных кислот зависят от наличия кратных связей – с ростом их числа соответствующие температуры уменьшаются.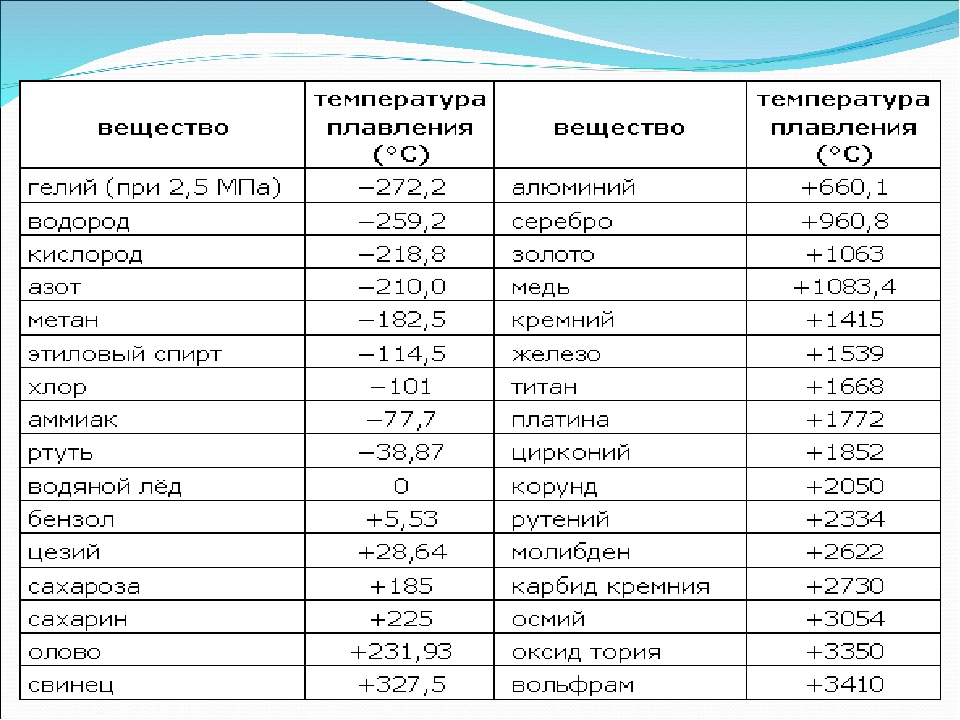
Температуры кипения и плавления кислот значительно выше температур кипения и плавления спиртов и альдегидов с тем же количеством атомов углерода.
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей. Водородная связь, образуемая водородом гидроксильной группы одной молекулы с карбонильным кислородом другой, более прочная, чем в спиртах.
В твердом и жидком состоянии молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей в устойчивые циклические димеры:
Между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
Молекулы муравьиной и уксусной кислот за счёт водородных связей могут образовывать димеры, которые не разрушаются даже в паровой фазе. Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Растворимость карбоновых кислот в воде несколько выше, чем у спиртов, так как и с водой кислоты образуют более прочные водородные связи.
В водных растворах кислоты образуют линейные димеры:
Отсутствие среди карбоновых кислот газообразных веществ связано с межмолекулярной ассоциацией (соединением) молекул посредством водородных связей.
Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
3-9% водный раствор кислоты известен под названием столового уксуса, который применяется как приправа к пище. 70-80% уксусная кислота называется уксусной эссенцией.
Уксусная кислота смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.
Видеоопыт «Замораживание уксусной кислоты (демонстрация ледяной уксусной кислоты)»
Пальмитиновая и стеариновая кислоты — твердые вещества, белого цвета, жирные на ощупь, нерастворимы в воде, умеренно растворимы в спирте, эфире, хлороформе и других органических растворителях.
Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,40С) — легко возгоняется, т. е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
Видеоопыт «Возгонка бензойной кислоты»
Карбоновые кислоты
Свойства жиров — урок. Химия, 8–9 класс.
Физические свойства
Различают жиры растительные и животные.
Растительные жиры часто называют маслами (подсолнечное, кукурузное, оливковое, рапсовое). При комнатной температуре они находятся в жидком агрегатном состоянии. Но есть и исключения. Например, кокосовое масло при обычных условиях — твёрдый жир.
Рис. \(1\). Оливковое масло
Жиры животного происхождения при комнатной температуре, как правило, находятся в твёрдом агрегатном состоянии, но при небольшом нагревании становятся жидкими. Реже встречаются жидкие животные жиры, например, рыбий жир. Твёрдые жиры не имеют кристаллического строения и представляют собой мазеподобные субстанции.
Реже встречаются жидкие животные жиры, например, рыбий жир. Твёрдые жиры не имеют кристаллического строения и представляют собой мазеподобные субстанции.
Рис. \(2\). Сливочное масло
Температура плавления жира зависит от его состава.
В состав твёрдых жиров входят преимущественно остатки высших насыщенных карбоновых кислот (пальмитиновой и стеариновой).
В состав растительных масел входят преимущественно глицериды высших ненасыщенных карбоновых кислот (олеиновой и др.).
Все жиры легче воды и в воде не растворяются. Растворить жир можно органическим растворителем — бензином, хлороформом, бензолом.
Химические свойства
- Жидкий жир может присоединять водород, т.
 е. подвергаться гидрированию. Радикалы ненасыщенных кислот превращаются в радикалы насыщенных карбоновых кислот, и жир становится твёрдым. Так растительные масла превращают в твёрдые жиры и получают маргарин.
е. подвергаться гидрированию. Радикалы ненасыщенных кислот превращаются в радикалы насыщенных карбоновых кислот, и жир становится твёрдым. Так растительные масла превращают в твёрдые жиры и получают маргарин. - Жиры могут вступать в реакцию с водой в присутствии минеральных кислот. Происходит кислотный гидролиз (разложение водой). При этом образуются глицерин и карбоновые кислоты:
- Если гидролиз проводят в присутствии щёлочи, то происходит омыление жира. В результате образуются соли карбоновых кислот, которые называют мылами:
Источники:
Рис. 1. Оливковое масло https://cdn.pixabay.com/photo/2018/04/17/06/58/olive-oil-3326715_960_720.jpg
Рис. 2. Сливочное масло https://cdn. pixabay.com/photo/2018/05/18/12/55/butter-3411126_960_720.jpg
pixabay.com/photo/2018/05/18/12/55/butter-3411126_960_720.jpg
что это такое, харизма, модели с керамическим напылением, hairway
Для того чтобы ваши волосы имели здоровый и ухоженный вид необходимо постоянно о них заботиться т. е. делать маски, укреплять их, сушить и пр. Расчески в этом деле также играют немаловажную роль. Поэтому каждая женщина должна иметь несколько различных видов. От правильного выбора зависит здоровье структуры волос.
Что это, плюсы и минусы
Карбоновый вид среди большого многообразия пользуется большей популярностью из-за своих особенностей. Он стал массово доступным совсем недавно, ранее таким предметом в своем арсенале могли похвастаться лишь профессиональные парикмахеры. Эти расчески сделаны из карбона, который относится к углеродным материалам, и имеют керамическое напыление.
Эти расчески сделаны из карбона, который относится к углеродным материалам, и имеют керамическое напыление.
Плюсы и минусы карбоновых расчесок:
- Не электризуют волосы, незаменимы для создания начеса.
- Удобно разделяют волосы.
- Не наносят вреда структуре волос, но и не приносят какой-либо огромной пользы.
- Хорошо подходят для окрашивания, не реагируют на химические средства.
- Не требуют особого ухода, не загрязняются.
- Карбоновый каркас обеспечивает высокую прочность к любым ударам.
- Не реагируют на высокую температуру: не плавятся и не трескаются.
youtube.com/embed/nfljIrmQ1UY?modestbranding=1&iv_load_policy=3&rel=0″/>
В целом карбоновые расчески не имеют явных минусов. Они бережно заботятся о любом типе волос.
Модели
Поскольку этот вид щеток пользуется огромной популярностью у девушек, которые заботятся о своих волосах, то ведущие производители предоставляют большой ассортимент моделей с керамическим напылением.
Больше всего пользуются спросом у дам:
- Гребни. Они подходят для создания причесок любой сложности, разделения прядей на пробор, окрашивания, а также для обычного расчесывания.
- Традиционные варианты расчесок с широкими или узкими зубчиками.
 Такие аксессуары отлично подходят для стрижки и укладки.
Такие аксессуары отлично подходят для стрижки и укладки. - Вариант с нечастыми зубчиками. Его выбирают обладательницы густых, длинных, волнистых и непослушных волос.
- Щетка. Подходит для тех, кто в поиске предмета для ежедневного ухода. Она трепетно относится к волосам, как к сухим, так и влажным. Обеспечивает легкий и быстрый процесс расчесывания. Постоянное использование щетки помогает предотвратить выпадение и ломкость волос. Бережно распутывает, делает волосы гладкими и послушными, заряжает их блеском.
Бренды
Hairway Professional
Расчески в виде гребня прекрасно подходят как для профессионального, так и для домашнего использования. Они очень прочные и долго служат. Прочное керамическое покрытие не зависит от каких-либо красок, химикатов, высоких температур и пр. Девушки выбирают продукцию данной марки из-за ее многофункциональности и удобства в применении.
Девушки выбирают продукцию данной марки из-за ее многофункциональности и удобства в применении.
Harizma
Преобладающее большинство товаров – это расчески с широкими и узкими зубьями, которые подходят для женских стрижек и укладок. Единственный минус данного бренда в том, что единица продукции имеет не очень доступную цену, которая иногда слишком завышена.
Erika
Расчески от компании Erika отлично справляются с формированием четкого, ровного пробора, с созданием как сложных, так и простых причесок, а также с расчесыванием волос несколько раз в день. Основным преимуществом этого бренда покупательницы называют антистатический эффект.
Easy Combing
Щетки для ежедневного ухода бережно заботятся о волосах. Они имеют красивый дизайн и их удобно держать в руке. Главной особенностью массажной щетки Easy Combing является то, что все зубчики имеют разную длину. Это позволяет без особых усилий справиться с запутанными волосками. Кроме того, что щетки можно использовать на ежедневной основе, они идеально подходят для распределения масок или различных масел по всей длине, что обеспечивает лучшее проникновение полезных свойств в волосяную структуру.
Отзывы
Самые частые рецензии от покупательниц карбоновых расчесок:
- Не имеют неприятного, резкого запаха.

- Не травмируют кожу головы.
- Карбоновые расчески обладают антистатичностью, именно поэтому они заняли заслуженное место в арсенале расчесок.
- Такой предмет абсолютно незаменим в создании любых причесок. Если нужно сформировать ровный пробор, выделить маленькую прядь или поправить волосы, то наличие такого гребня с легкостью вас выручит.
- Прочное покрытие гарантирует долгое использование. Не придется менять расческу через полгода.
Покупательницы, которые отдали свое предпочтение карбоновым расческам, остаются довольны своим приобретением долгое время.
углерод | Факты, использование и свойства
Свойства и использование
По весу углерод занимает 19-е место по распространенности элементов в земной коре, и, по оценкам, атомов углерода в 3,5 раза больше, чем атомов кремния во Вселенной. Только водорода, гелия, кислорода, неона и азота атомарно больше в космосе, чем углерода. Углерод — это космический продукт «сгорания» гелия, при котором три ядра гелия с атомным весом 4 сливаются, образуя ядро углерода с атомным весом 12.
Углерод — это космический продукт «сгорания» гелия, при котором три ядра гелия с атомным весом 4 сливаются, образуя ядро углерода с атомным весом 12.
Викторина Британника
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
В земной коре элементарный углерод является второстепенным компонентом. Однако соединения углерода (т.карбонаты магния и кальция) образуют обычные минералы (например, магнезит, доломит, мрамор или известняк). Кораллы и раковины устриц и моллюсков в основном состоят из карбоната кальция. Углерод широко распространен в виде угля и органических соединений, составляющих нефть, природный газ и все ткани растений и животных. Естественная последовательность химических реакций, называемая углеродным циклом, включающая превращение атмосферного углекислого газа в углеводы путем фотосинтеза в растениях, потребление этих углеводов животными и их окисление посредством метаболизма с образованием двуокиси углерода и других продуктов, а также возврат углерода. двуокиси в атмосферу — один из важнейших биологических процессов.
двуокиси в атмосферу — один из важнейших биологических процессов.
Углерод как элемент был открыт первым человеком, который достал древесный уголь из огня. Таким образом, наряду с серой, железом, оловом, свинцом, медью, ртутью, серебром и золотом углерод был одним из небольшой группы элементов, хорошо известных в древнем мире. Современная углеродная химия восходит к разработке углей, нефти и природного газа в качестве топлива и к выяснению синтетической органической химии, которые существенно развились с 1800-х годов.
Элементарный углерод существует в нескольких формах, каждая из которых имеет свои физические характеристики.Две его четко определенные формы, алмаз и графит, имеют кристаллическую структуру, но различаются по физическим свойствам, поскольку расположение атомов в их структурах неодинаково. Третья форма, называемая фуллереном, состоит из множества молекул, полностью состоящих из углерода. Сфероидальные фуллерены с закрытой клеткой называются бакерминстерфуллеренами, или «бакиболами», а цилиндрические фуллерены называются нанотрубками. Четвертая форма, называемая Q-углеродом, является кристаллической и магнитной. Еще одна форма, называемая аморфным углеродом, не имеет кристаллической структуры.Другие формы — сажа, древесный уголь, ламповая сажа, уголь, кокс — иногда называют аморфными, но рентгенологическое исследование показало, что эти вещества действительно обладают низкой степенью кристалличности. Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 году как синтетический продукт в ходе лабораторных экспериментов по моделированию химических процессов в атмосфере звезд-гигантов.Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Четвертая форма, называемая Q-углеродом, является кристаллической и магнитной. Еще одна форма, называемая аморфным углеродом, не имеет кристаллической структуры.Другие формы — сажа, древесный уголь, ламповая сажа, уголь, кокс — иногда называют аморфными, но рентгенологическое исследование показало, что эти вещества действительно обладают низкой степенью кристалличности. Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 году как синтетический продукт в ходе лабораторных экспериментов по моделированию химических процессов в атмосфере звезд-гигантов.Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Две фуллереновые структуры: удлиненная углеродная нанотрубка и сферический бакминстерфуллерен, или «бакибол».
Слово углерод , вероятно, происходит от латинского карбо , означающего по-разному «уголь», «древесный уголь», «угольки».Термин алмаз , искаженное греческое слово адамас , «непобедимый», точно описывает постоянство этой кристаллизованной формы углерода, точно так же, как графит , название другой кристаллической формы углерода, производной от греческого глагола graphein , «писать», отражает его свойство оставлять темный след при трении на поверхности. До открытия в 1779 году, что графит при сгорании на воздухе образует углекислый газ, графит путали как с металлическим свинцом, так и с внешне похожим веществом, минералом молибденитом.
Чистый алмаз является самым твердым известным природным веществом и плохо проводит электричество. Графит, с другой стороны, представляет собой мягкое скользкое твердое вещество, которое является хорошим проводником как тепла, так и электричества. Углерод, как и алмаз, является самым дорогим и блестящим из всех природных драгоценных камней и самым твердым из встречающихся в природе абразивов. Графит используется в качестве смазки. В микрокристаллическом и почти аморфном виде используется как черный пигмент, как адсорбент, как горючее, как наполнитель для каучука, а в смеси с глиной — как «грифель» карандашей.Поскольку он проводит электричество, но не плавится, графит также используется для электродов в электрических печах и сухих камерах, а также для изготовления тиглей, в которых плавятся металлы. Молекулы фуллерена перспективны в ряде применений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 K (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы.
Углерод, как и алмаз, является самым дорогим и блестящим из всех природных драгоценных камней и самым твердым из встречающихся в природе абразивов. Графит используется в качестве смазки. В микрокристаллическом и почти аморфном виде используется как черный пигмент, как адсорбент, как горючее, как наполнитель для каучука, а в смеси с глиной — как «грифель» карандашей.Поскольку он проводит электричество, но не плавится, графит также используется для электродов в электрических печах и сухих камерах, а также для изготовления тиглей, в которых плавятся металлы. Молекулы фуллерена перспективны в ряде применений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 K (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы. Элементарный углерод нетоксичен.
Элементарный углерод нетоксичен.
Каждая из «аморфных» форм углерода имеет свою специфику, и, следовательно, каждая из них имеет свои особенности применения. Все они являются продуктами окисления и других форм разложения органических соединений. Уголь и кокс, например, широко используются в качестве топлива. Древесный уголь используется в качестве абсорбирующего и фильтрующего агента, а также в качестве топлива, а когда-то широко использовался в качестве ингредиента пороха. (Угли — это элементарный углерод, смешанный с различным количеством соединений углерода.Кокс и древесный уголь представляют собой почти чистый углерод. Помимо использования в производстве чернил и красок, технический углерод добавляется в резину, используемую в шинах, для улучшения ее износостойкости. Костяная сажа или древесный уголь животных может поглощать газы и красящие вещества из многих других материалов.
Углерод, элементарный или связанный, обычно определяют количественно путем преобразования в газообразный диоксид углерода, который затем может поглощаться другими химическими веществами с получением взвешиваемого продукта или раствора с кислотными свойствами, который можно титровать.
Производство элементарного углерода
До 1955 г. все алмазы добывались из природных месторождений, наиболее значительных на юге Африки, но встречающихся также в Бразилии, Венесуэле, Гайане и Сибири. Единственный известный источник в США, в Арканзасе, не имеет коммерческого значения; и Индия, которая когда-то была источником чистых алмазов, в настоящее время не является важным поставщиком. Основным источником алмазов является мягкая голубоватая перидотическая порода, называемая кимберлитом (в честь знаменитого месторождения Кимберли, Южная Африка), обнаруженная в вулканических структурах, называемых трубками, но многие алмазы встречаются в аллювиальных отложениях, предположительно образовавшихся в результате выветривания первичных источников.Единичные находки по всему миру в регионах, где не указаны источники, не были редкостью.
Природные месторождения разрабатываются дроблением, гравитационной и флотационной сепарацией и удалением алмазов путем прилипания их к слою смазки на подходящем столе. В результате получаются следующие продукты: (1) собственно алмаз — деформированные кубические кристаллические камни ювелирного качества, варьирующиеся от бесцветных до красных, розовых, голубых, зеленых или желтых; (2) борт — мельчайшие темные кристаллы абразивного, но не ювелирного качества; 3) баллас – беспорядочно ориентированные кристаллы абразивного качества; 4) маклеры — треугольные подушкообразные кристаллы, используемые в промышленности; 5) карбонадо – смешанные алмазно-графитовые кристаллиты, содержащие другие примеси.
В результате получаются следующие продукты: (1) собственно алмаз — деформированные кубические кристаллические камни ювелирного качества, варьирующиеся от бесцветных до красных, розовых, голубых, зеленых или желтых; (2) борт — мельчайшие темные кристаллы абразивного, но не ювелирного качества; 3) баллас – беспорядочно ориентированные кристаллы абразивного качества; 4) маклеры — треугольные подушкообразные кристаллы, используемые в промышленности; 5) карбонадо – смешанные алмазно-графитовые кристаллиты, содержащие другие примеси.
Успешная лабораторная конверсия графита в алмаз была осуществлена в 1955 году. Процедура включала одновременное использование чрезвычайно высокого давления и температуры с железом в качестве растворителя или катализатора. Впоследствии железо заменили хромом, марганцем, кобальтом, никелем и танталом. Синтетические алмазы в настоящее время производятся в нескольких странах и все чаще используются вместо природных материалов в качестве промышленных абразивов.
Графит встречается в природе во многих областях, наиболее важные месторождения находятся в Китае, Индии, Бразилии, Турции, Мексике, Канаде, России и на Мадагаскаре.Применяются методы как поверхностной, так и глубокой добычи с последующей флотацией, но основная часть товарного графита производится путем нагревания нефтяного кокса в электропечах. Лучше кристаллизованная форма, известная как пиролитический графит, получается при разложении низкомолекулярных углеводородов при нагревании. Графитовые волокна значительной прочности на разрыв получают путем карбонизации натуральных и синтетических органических волокон.
Углеродные продукты получают путем нагревания угля (для получения кокса), природного газа (для получения сажи) или углеродсодержащего материала растительного или животного происхождения, такого как древесина или кость (для получения древесного угля), при повышенных температурах в присутствии недостаточно кислорода для горения.Летучие побочные продукты выделяют и используют отдельно.
углерод | Факты, использование и свойства
Свойства и использование
По весу углерод занимает 19-е место по распространенности элементов в земной коре, и, по оценкам, атомов углерода в 3,5 раза больше, чем атомов кремния во Вселенной. Только водорода, гелия, кислорода, неона и азота атомарно больше в космосе, чем углерода. Углерод — это космический продукт «сгорания» гелия, при котором три ядра гелия с атомным весом 4 сливаются, образуя ядро углерода с атомным весом 12.
Викторина Британника
36 вопросов из самых популярных научных викторин Britannica
Насколько хорошо ты знаешь астрономию? Как насчет квантовой механики? Эта викторина проведет вас через 36 самых сложных вопросов из самых популярных викторин Britannica о естественных науках. Только лучшие викторины закончат его.
В земной коре элементарный углерод является второстепенным компонентом. Однако соединения углерода (например, карбонаты магния и кальция) образуют обычные минералы (например, магнезит, доломит, мрамор или известняк). Кораллы и раковины устриц и моллюсков в основном состоят из карбоната кальция. Углерод широко распространен в виде угля и органических соединений, составляющих нефть, природный газ и все ткани растений и животных. Естественная последовательность химических реакций, называемая углеродным циклом, включающая превращение атмосферного углекислого газа в углеводы путем фотосинтеза в растениях, потребление этих углеводов животными и их окисление посредством метаболизма с образованием двуокиси углерода и других продуктов, а также возврат углерода. двуокиси в атмосферу — один из важнейших биологических процессов.
Углерод как элемент был открыт первым человеком, который достал древесный уголь из огня. Таким образом, наряду с серой, железом, оловом, свинцом, медью, ртутью, серебром и золотом углерод был одним из небольшой группы элементов, хорошо известных в древнем мире. Современная углеродная химия восходит к разработке углей, нефти и природного газа в качестве топлива и к выяснению синтетической органической химии, которые существенно развились с 1800-х годов.
Современная углеродная химия восходит к разработке углей, нефти и природного газа в качестве топлива и к выяснению синтетической органической химии, которые существенно развились с 1800-х годов.
Элементарный углерод существует в нескольких формах, каждая из которых имеет свои физические характеристики.Две его четко определенные формы, алмаз и графит, имеют кристаллическую структуру, но различаются по физическим свойствам, поскольку расположение атомов в их структурах неодинаково. Третья форма, называемая фуллереном, состоит из множества молекул, полностью состоящих из углерода. Сфероидальные фуллерены с закрытой клеткой называются бакерминстерфуллеренами, или «бакиболами», а цилиндрические фуллерены называются нанотрубками. Четвертая форма, называемая Q-углеродом, является кристаллической и магнитной. Еще одна форма, называемая аморфным углеродом, не имеет кристаллической структуры.Другие формы — сажа, древесный уголь, ламповая сажа, уголь, кокс — иногда называют аморфными, но рентгенологическое исследование показало, что эти вещества действительно обладают низкой степенью кристалличности. Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 году как синтетический продукт в ходе лабораторных экспериментов по моделированию химических процессов в атмосфере звезд-гигантов.Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 году как синтетический продукт в ходе лабораторных экспериментов по моделированию химических процессов в атмосфере звезд-гигантов.Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Две фуллереновые структуры: удлиненная углеродная нанотрубка и сферический бакминстерфуллерен, или «бакибол».
Encyclopædia Britannica, Inc. Слово углерод , вероятно, происходит от латинского карбо , означающего по-разному «уголь», «древесный уголь», «угольки».Термин алмаз , искаженное греческое слово адамас , «непобедимый», точно описывает постоянство этой кристаллизованной формы углерода, точно так же, как графит , название другой кристаллической формы углерода, производной от греческого глагола graphein , «писать», отражает его свойство оставлять темный след при трении на поверхности. До открытия в 1779 году, что графит при сгорании на воздухе образует углекислый газ, графит путали как с металлическим свинцом, так и с внешне похожим веществом, минералом молибденитом.
До открытия в 1779 году, что графит при сгорании на воздухе образует углекислый газ, графит путали как с металлическим свинцом, так и с внешне похожим веществом, минералом молибденитом.
Чистый алмаз является самым твердым известным природным веществом и плохо проводит электричество. Графит, с другой стороны, представляет собой мягкое скользкое твердое вещество, которое является хорошим проводником как тепла, так и электричества. Углерод, как и алмаз, является самым дорогим и блестящим из всех природных драгоценных камней и самым твердым из встречающихся в природе абразивов. Графит используется в качестве смазки. В микрокристаллическом и почти аморфном виде используется как черный пигмент, как адсорбент, как горючее, как наполнитель для каучука, а в смеси с глиной — как «грифель» карандашей.Поскольку он проводит электричество, но не плавится, графит также используется для электродов в электрических печах и сухих камерах, а также для изготовления тиглей, в которых плавятся металлы. Молекулы фуллерена перспективны в ряде применений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 K (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы.Элементарный углерод нетоксичен.
Молекулы фуллерена перспективны в ряде применений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 K (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы.Элементарный углерод нетоксичен.
Каждая из «аморфных» форм углерода имеет свою специфику, и, следовательно, каждая из них имеет свои особенности применения. Все они являются продуктами окисления и других форм разложения органических соединений. Уголь и кокс, например, широко используются в качестве топлива. Древесный уголь используется в качестве абсорбирующего и фильтрующего агента, а также в качестве топлива, а когда-то широко использовался в качестве ингредиента пороха. (Угли — это элементарный углерод, смешанный с различным количеством соединений углерода.Кокс и древесный уголь представляют собой почти чистый углерод. Помимо использования в производстве чернил и красок, технический углерод добавляется в резину, используемую в шинах, для улучшения ее износостойкости. Костяная сажа или древесный уголь животных может поглощать газы и красящие вещества из многих других материалов.
(Угли — это элементарный углерод, смешанный с различным количеством соединений углерода.Кокс и древесный уголь представляют собой почти чистый углерод. Помимо использования в производстве чернил и красок, технический углерод добавляется в резину, используемую в шинах, для улучшения ее износостойкости. Костяная сажа или древесный уголь животных может поглощать газы и красящие вещества из многих других материалов.
Углерод, элементарный или связанный, обычно определяют количественно путем преобразования в газообразный диоксид углерода, который затем может поглощаться другими химическими веществами с получением взвешиваемого продукта или раствора с кислотными свойствами, который можно титровать.
Производство элементарного углерода
До 1955 г. все алмазы добывались из природных месторождений, наиболее значительных на юге Африки, но встречающихся также в Бразилии, Венесуэле, Гайане и Сибири. Единственный известный источник в США, в Арканзасе, не имеет коммерческого значения; и Индия, которая когда-то была источником чистых алмазов, в настоящее время не является важным поставщиком. Основным источником алмазов является мягкая голубоватая перидотическая порода, называемая кимберлитом (в честь знаменитого месторождения Кимберли, Южная Африка), обнаруженная в вулканических структурах, называемых трубками, но многие алмазы встречаются в аллювиальных отложениях, предположительно образовавшихся в результате выветривания первичных источников.Единичные находки по всему миру в регионах, где не указаны источники, не были редкостью.
Основным источником алмазов является мягкая голубоватая перидотическая порода, называемая кимберлитом (в честь знаменитого месторождения Кимберли, Южная Африка), обнаруженная в вулканических структурах, называемых трубками, но многие алмазы встречаются в аллювиальных отложениях, предположительно образовавшихся в результате выветривания первичных источников.Единичные находки по всему миру в регионах, где не указаны источники, не были редкостью.
Природные месторождения разрабатываются дроблением, гравитационной и флотационной сепарацией и удалением алмазов путем прилипания их к слою смазки на подходящем столе. В результате получаются следующие продукты: (1) собственно алмаз — деформированные кубические кристаллические камни ювелирного качества, варьирующиеся от бесцветных до красных, розовых, голубых, зеленых или желтых; (2) борт — мельчайшие темные кристаллы абразивного, но не ювелирного качества; 3) баллас – беспорядочно ориентированные кристаллы абразивного качества; 4) маклеры — треугольные подушкообразные кристаллы, используемые в промышленности; 5) карбонадо – смешанные алмазно-графитовые кристаллиты, содержащие другие примеси.
Успешная лабораторная конверсия графита в алмаз была осуществлена в 1955 году. Процедура включала одновременное использование чрезвычайно высокого давления и температуры с железом в качестве растворителя или катализатора. Впоследствии железо заменили хромом, марганцем, кобальтом, никелем и танталом. Синтетические алмазы в настоящее время производятся в нескольких странах и все чаще используются вместо природных материалов в качестве промышленных абразивов.
Графит встречается в природе во многих областях, наиболее важные месторождения находятся в Китае, Индии, Бразилии, Турции, Мексике, Канаде, России и на Мадагаскаре.Применяются методы как поверхностной, так и глубокой добычи с последующей флотацией, но основная часть товарного графита производится путем нагревания нефтяного кокса в электропечах. Лучше кристаллизованная форма, известная как пиролитический графит, получается при разложении низкомолекулярных углеводородов при нагревании. Графитовые волокна значительной прочности на разрыв получают путем карбонизации натуральных и синтетических органических волокон.
Углеродные продукты получают путем нагревания угля (для получения кокса), природного газа (для получения сажи) или углеродсодержащего материала растительного или животного происхождения, такого как древесина или кость (для получения древесного угля), при повышенных температурах в присутствии недостаточно кислорода для горения.Летучие побочные продукты выделяют и используют отдельно.
Углерод — точка плавления — температура кипения
Углерод — точка плавления и температура кипения
Температура плавления углерода 3367°C .
Температура кипения углерода 4827°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданной температуре и давлении.Температура, при которой начинает происходить испарение (кипение) при данном давлении, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Точка плавления
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии.Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода от жидкого к твердому, ее называют точкой замерзания или точкой кристаллизации.
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебание атомов в кристалле для объяснения плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа. Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. Движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг неподвижной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее, поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления.Точка плавления 90 115 – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. Движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг неподвижной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее, поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления.Точка плавления 90 115 – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
| Элемент | 9 | 9 | C | Элемент | Nontar Metal |
|---|---|---|---|---|
| Фаза при STP | Твердое вещество | |||
Атомная масса [а. е.м.] е.м.] | 12.0107 | |||
| Плотность на STP [G / CM3] | 2.26 | |||
| Электронная конфигурация | [Он] 2S2 2P2 | |||
| возможные состояния окисления | + 2,4 / -4 | |||
| Сходство [KJ / MOL] | 153.9 | |||
| Электронегативность [Pauling Scale] | 2.55 | |||
| 11.2603 | ||||
| Год открытия | Неизвестный | |||
| Discoverer | Неизвестный | |||
| Point Planting [Cellius Scale] | 3967 | |||
| 4999 | ||||
| Термальная проводимость [W / M K] | 129 | |||
| Удельная теплоемкость [Дж/г·К] | 0.71 | Тепло Fusion [KJ / Mol] | — | |
| Тепло испарения [KJ / MOL] | 355. 8 8 |
—
—
—
Температура плавления алмаза при сверхвысоком давлении
В результате важности углерода высокого давления как в планетологии, так и в термоядерном синтезе с инерционным удержанием (для которого углерод высокой плотности является кандидатом на материал для аблятора для конструкций мишеней воспламенения), существует множество теоретических расчетов высокой — кривая плавления алмаза под давлением, при этом некоторые предсказывают максимум температуры при 500 ГПа (5 Мбар; ссылки 8, 9, 10, 11).Прямые измерения температуры сложны как для статических, так и для динамических экспериментов при высоком давлении, поэтому подтверждение предсказаний кривой плавления было только на основе вывода, а не путем прямого измерения. В статических условиях данные уравнения состояния, относящиеся к плавлению алмаза, не распространяются на давления намного выше 50 ГПа и интерпретируются как указывающие на положительный наклон Клапейрона, ( ∂ T / ∂ P ) расплав >0, для алмаза до 60 ГПа (ссылки 5, 6, 12, 13). Эксперименты с динамическим ударом на графите, который, как считается, превращается в алмаз при динамической нагрузке, предполагают положительную крутизну плавления по крайней мере до 140 ГПа (ссылки 14, 15, 16). Наконец, недавние ударные эксперименты с алмазом показывают увеличение плотности около 600 ГПа, что позволяет предположить, что алмаз, подвергшийся ударному воздействию, потенциально может плавиться с отрицательной кривой плавления около 600 ГПа (ссылки 17, 18, 19, 20).
Эксперименты с динамическим ударом на графите, который, как считается, превращается в алмаз при динамической нагрузке, предполагают положительную крутизну плавления по крайней мере до 140 ГПа (ссылки 14, 15, 16). Наконец, недавние ударные эксперименты с алмазом показывают увеличение плотности около 600 ГПа, что позволяет предположить, что алмаз, подвергшийся ударному воздействию, потенциально может плавиться с отрицательной кривой плавления около 600 ГПа (ссылки 17, 18, 19, 20).
Здесь мы сообщаем о первых измерениях температуры ударно-сжатого алмаза в условиях 0,6–4 ТПа (6–40 Мбар) и 8000–100000 К.Эти данные показывают кривую плавления углерода до 1,1 ТПа и сложное флюидное состояние между 1,2 и 2,5 ТПа. В ударных экспериментах традиционно исследуется стационарный удар Гюгонио, характеризующийся скоростью ударной волны U с , скоростью частиц U p , давлением P , удельным объемом V , (=1/плотность) и внутренней энергией. E из ударопрочного материала. Эти пять переменных связаны тремя соотношениями Ренкина-Гюгонио, так что состояние образца при ударном нагружении определяется одним измерением, если P – V – E Гюгонио было определено ранее.В наших экспериментах используется безопорный скачок давления, давление которого со временем затухает, а на фронте удара P , V , E , U s и U p и по-прежнему подчиняются массе, импульсу сохранение энергии и, следовательно, соотношения Ренкина–Гюгонио 21 . Таким образом, ударная волна без поддержки представляет собой континуум состояний Гюгонио по мере того, как ударная волна развивается во времени и пространстве. Мы измеряем ударную скорость U с в настоящих экспериментах и используем модель Гюгонио 22 , которая хорошо представляет собой компиляцию новых экспериментов Гюгонио 17,18,19,20 .Кроме того, мы измеряем переменные, не относящиеся к Ренкину-Гюгонио T , и отражательную способность R λ = 532 нашего образца в видимом диапазоне длин волн ( λ = 532 нм).
E из ударопрочного материала. Эти пять переменных связаны тремя соотношениями Ренкина-Гюгонио, так что состояние образца при ударном нагружении определяется одним измерением, если P – V – E Гюгонио было определено ранее.В наших экспериментах используется безопорный скачок давления, давление которого со временем затухает, а на фронте удара P , V , E , U s и U p и по-прежнему подчиняются массе, импульсу сохранение энергии и, следовательно, соотношения Ренкина–Гюгонио 21 . Таким образом, ударная волна без поддержки представляет собой континуум состояний Гюгонио по мере того, как ударная волна развивается во времени и пространстве. Мы измеряем ударную скорость U с в настоящих экспериментах и используем модель Гюгонио 22 , которая хорошо представляет собой компиляцию новых экспериментов Гюгонио 17,18,19,20 .Кроме того, мы измеряем переменные, не относящиеся к Ренкину-Гюгонио T , и отражательную способность R λ = 532 нашего образца в видимом диапазоне длин волн ( λ = 532 нм).
Мы использовали лазер OMEGA в Университете Рочестера для создания ударов в алмазных мишенях путем фокусировки импульсов длительностью 1 нс и мощностью до 3 кДж света с длиной волны 351 нм в плоское пятно диаметром ~600 мкм (рис. 1а). Использовались как монокристаллические диски из природного алмаза типа 1а, так и поликристаллические синтетические алмазные диски типа 2а, причем последние были сформированы химическим осаждением из паровой фазы и имели средний размер зерен около 130 мкм с небольшой предпочтительной ориентацией.Любые различия, связанные с типом образца, находились в пределах наших экспериментальных неопределенностей. Определены плотность ( ρ 0 ) и показатель преломления ( n ) алмаза в условиях окружающей среды: = 2,42 (± 0,02) при λ = 532 нм.
Рис. 1. Экспериментальная конфигурация и данные, собранные для определения температуры плавления алмаза. a , Алмазная мишень для расплава. b , Данные интерферометрии скоростей (VISAR) для поликристаллического алмаза, показывающие необработанные данные интерференционных полос и контур скорости ( U s ). Давление падает непрерывно и плавно со временем по мере уменьшения U с c , данные SOP, показывающие необработанные данные и линейку интенсивности. Интенсивность SOP выходит на плато и повышается даже при плавном снижении U s .
b , Данные интерферометрии скоростей (VISAR) для поликристаллического алмаза, показывающие необработанные данные интерференционных полос и контур скорости ( U s ). Давление падает непрерывно и плавно со временем по мере уменьшения U с c , данные SOP, показывающие необработанные данные и линейку интенсивности. Интенсивность SOP выходит на плато и повышается даже при плавном снижении U s .
На протяжении большей части своего прохождения через образец фронт затухающей ударной волны отражает, и мгновенные U с и R λ =532 измеряются как функция времени с помощью интерферометра скорости (VISAR ) (Инжир.1б). R λ =532 получается путем сравнения интенсивности сигнала VISAR от фронта ударной волны в алмазе с сигналом до ударной волны от эталона из алюминия. Одновременно измеряется абсолютная спектральная яркость на двух длинах волн, I ( λ ) с λ =650 и 450 нм, как функция времени с использованием полосового оптического пирометра 23 (СОП) и, в комбинации с R λ =532 , используется для определения T (рис. 1с; исх. 24), как указано в Дополнительной информации.
1с; исх. 24), как указано в Дополнительной информации.
Когда ударная волна без поддержки входит в алмаз на 1,8 нс, I ( λ ) (и T ) быстро возрастает до пикового значения (рис. 1c). Эти ранние высокие данные P и U s соответствуют самым высоким данным T в крайнем правом углу на рис. 2. , как и ожидалось, из-за затухания ударного давления во времени (рис.1с). Однако между 6 и 10 нс I ( λ ) фактически увеличивается, в то время как U s и P продолжают затухать. Это увеличение I ( λ ) наблюдалось в каждом эксперименте при U с крит = 24,6(±0,4) км с −1 (рис. 2). Аналогично, R λ =532 имеет значение насыщения 30(±10)% на первоначально высоком скачке P и U с , а затем начинает уменьшаться с уменьшением U 4 s at U s крит =24. 3(±0,3) км с −1 (рис. 2, верхняя вставка) до тех пор, пока фронт ударной волны не станет непрозрачным при U с ≤20,5 км с −1 . Объединив два результата, мы обнаруживаем значительное изменение Гюгонио алмаза при критической скорости ударной волны 24,4(±0,4) км с −1 (рис. 2, нижняя вставка).
3(±0,3) км с −1 (рис. 2, верхняя вставка) до тех пор, пока фронт ударной волны не станет непрозрачным при U с ≤20,5 км с −1 . Объединив два результата, мы обнаруживаем значительное изменение Гюгонио алмаза при критической скорости ударной волны 24,4(±0,4) км с −1 (рис. 2, нижняя вставка).
Поскольку давление ударного фронта с течением времени затухает, максимальные T , P точки соответствуют ранним временным условиям.На вставке вверху слева показаны измерения отражательной способности (синий цвет) вместе с данными Bradley et al. 7 (красный). Черная линия — усредненное значение. На нижней правой вставке показано аппроксимированное определение перегибов T – U s (красный) и R λ =532 плато (розовый), использованное для нахождения верхней границы области смешанной фазы. . Среднее значение и стандартное отклонение этих независимых определений показаны желтыми заштрихованными линиями по всему рисунку, как и скорость ударной волны при R λ =532 =0.5% в верхнем левом врезке. Неопределенности, показанные на основном рисунке, представляют собой взвешенное стандартное отклонение всех измерений при каждой скорости удара, как описано в дополнительной информации.
. Среднее значение и стандартное отклонение этих независимых определений показаны желтыми заштрихованными линиями по всему рисунку, как и скорость ударной волны при R λ =532 =0.5% в верхнем левом врезке. Неопределенности, показанные на основном рисунке, представляют собой взвешенное стандартное отклонение всех измерений при каждой скорости удара, как описано в дополнительной информации.
Если бы не было поглотителя энергии, значение Гюгонио T систематически уменьшалось бы как функция P . Вместо этого мы наблюдаем плато в ударной волне T между 0,6 и 1,1 ТПа (рис. 3), которое мы интерпретируем как наличие скрытой теплоты фазового перехода. Поскольку до очень высоких T наблюдается только одно плато, мы отождествляем его с переходом от жидкого состояния к твердому (соответствующему двухфазной области; см.25). Таким образом, мы делаем вывод, что алмаз плавится при температуре около 9000 К и между 0,60 и 1,05 ТПа вдоль кривой Гюгонио. Эти выводы согласуются с первыми принципами молекулярно-динамических расчетов кривой плавления (рис. 3; ссылки 8, 11), интерпретацией потери отражательной способности свободной поверхности при 550 ГПа (ссылка 7) и с недавними измерениями небольшие U s – U p изменения наклона, которые также согласуются с молекулярно-динамическими расчетами 8,19 .Наши эксперименты не обладают достаточной чувствительностью, чтобы различить предполагаемое наличие фазы ВС8 или тройной точки алмаз–ВС8–жидкий углерод 8,9,21 .
Эти выводы согласуются с первыми принципами молекулярно-динамических расчетов кривой плавления (рис. 3; ссылки 8, 11), интерпретацией потери отражательной способности свободной поверхности при 550 ГПа (ссылка 7) и с недавними измерениями небольшие U s – U p изменения наклона, которые также согласуются с молекулярно-динамическими расчетами 8,19 .Наши эксперименты не обладают достаточной чувствительностью, чтобы различить предполагаемое наличие фазы ВС8 или тройной точки алмаз–ВС8–жидкий углерод 8,9,21 .
Черная линия обозначает наши новые экспериментальные данные по ударной температуре. Синие кружки и синяя пунктирная линия представляют собой кривую плавления из расчетов теории функционала плотности Wang et al. , которые включают алмазную и жидкую фазы (арт.11). Коричневые треугольники, обрамляющие фазовые переходы, и коричневые пунктирные линии представляют аналогичные расчеты Correa et al. , которые включают алмаз, BC8 и флюидные фазы (ссылка 8). Наши измерения не могут идентифицировать несколько твердых фаз — будь то алмаз, BC8 или и то, и другое — как предсказывает теория. Графитовая фаза опущена для ясности. Неопределенности представляют собой взвешенное стандартное отклонение всех измерений, как описано в дополнительной информации.
, которые включают алмаз, BC8 и флюидные фазы (ссылка 8). Наши измерения не могут идентифицировать несколько твердых фаз — будь то алмаз, BC8 или и то, и другое — как предсказывает теория. Графитовая фаза опущена для ясности. Неопределенности представляют собой взвешенное стандартное отклонение всех измерений, как описано в дополнительной информации.
Данные отражательной способности ударно-сжатого алмаза предполагают, что жидкая фаза углерода является проводящей при P и T выше 1 ТПа и 10000 К (рис.2), что хорошо согласуется с расчетами из первых принципов, которые предсказывают металлизацию углерода в флюидной фазе при сопоставимых условиях 8,26 . R λ =532 увеличивается с P ниже нашего порога обнаружения 0,5% при P <0,6 ТПа до 30% для P >1,1 ТПа. Применяя модель Друде, эти данные дают оптическую толщину примерно 400 нм около 0,6 ТПа и падают до примерно 10 нм выше 1,1 ТПа, как обсуждается в дополнительной информации. Поскольку атомы совершают более 15 колебаний, а падение давления при прохождении ударной волны через оптическую глубину мало, ожидается, что состояние Гюгонио будет находиться в локальном термодинамическом равновесии. Хотя переход от смешанной фазы к полностью твердому углероду не был непосредственно определен в настоящих экспериментах, как насыщение отражательной способности в чистой флюидной фазе, так и теоретический вывод о том, что флюид является металлическим 8 , позволяют предположить, что начало плавления следует отождествлять с начало рефлексии.Среднее значение U с при R λ =532=0,5% (наш предел обнаружения) равно UsR=0,5%=20,5±0,6 км с −1 , 800 К).
Поскольку атомы совершают более 15 колебаний, а падение давления при прохождении ударной волны через оптическую глубину мало, ожидается, что состояние Гюгонио будет находиться в локальном термодинамическом равновесии. Хотя переход от смешанной фазы к полностью твердому углероду не был непосредственно определен в настоящих экспериментах, как насыщение отражательной способности в чистой флюидной фазе, так и теоретический вывод о том, что флюид является металлическим 8 , позволяют предположить, что начало плавления следует отождествлять с начало рефлексии.Среднее значение U с при R λ =532=0,5% (наш предел обнаружения) равно UsR=0,5%=20,5±0,6 км с −1 , 800 К).
Интерпретация кривой Гюгонио алмаза по кривой плавления от 0,6 до 1,05 ТПа позволяет оценить уклон Клапейрона, d T м /d P =Δ V m = -2,6(±0,6) K ГПа -1 для кривой плавления в этом диапазоне. Изменение энтропии Δ S m положительно при плавлении, что означает, что изменение объема при плавлении отрицательно. Отрицательный наклон Клапейрона в этом диапазоне давлений хорошо согласуется с предсказаниями теории (рис. 3), а уменьшение объема при пересечении кривой Гюгонио температуры плавления алмаза также подтверждается недавними экспериментами по ударному сжатию 17,18. ,19,20 .
Изменение энтропии Δ S m положительно при плавлении, что означает, что изменение объема при плавлении отрицательно. Отрицательный наклон Клапейрона в этом диапазоне давлений хорошо согласуется с предсказаниями теории (рис. 3), а уменьшение объема при пересечении кривой Гюгонио температуры плавления алмаза также подтверждается недавними экспериментами по ударному сжатию 17,18. ,19,20 .
Используя наши измерения температуры Гюгонио, мы можем извлечь удельную теплоемкость 27 , как описано в дополнительной информации.Непосредственно перед плавлением образец находится при температуре, намного превышающей температуру Дебая алмаза (∼2200 K), поэтому удельная теплоемкость должна быть близка к пределу Дюлонга–Пти, равному 3 Н k B ( k B – постоянная Больцмана). В жидкости удельная теплоемкость показывает широкий пик с C V ≈4,6 k B между 10 000 и 30 000 K (рис. 4), что указывает на избыточный сток энергии. При более высокой температуре C V в конечном итоге приближается к 3 N k B примерно при 70 000 K после первого падения ниже предела Дюлонга – Пти.Мы считаем маловероятным, что этот пик в C V обусловлен изменением ионизации, поскольку коэффициент отражения остается постоянным на уровне около 30% во всем этом диапазоне P – T (рис. 2, верхняя часть). вставка). Точно так же высокие значения удельной теплоемкости наблюдаются чуть выше температур плавления кварца, плавленого кварца, многих галогенидов щелочных металлов, кремния и германия и интерпретируются как диссоциация ближнего порядка жидкости. Высокая удельная теплоемкость Si и Ge коррелирует с аномальным структурным фактором жидкости, и существует явная связь между структурным фактором и удельной теплоемкостью для жидкости, описываемой парными взаимодействиями (уравнение 4.3,24; исх.
4), что указывает на избыточный сток энергии. При более высокой температуре C V в конечном итоге приближается к 3 N k B примерно при 70 000 K после первого падения ниже предела Дюлонга – Пти.Мы считаем маловероятным, что этот пик в C V обусловлен изменением ионизации, поскольку коэффициент отражения остается постоянным на уровне около 30% во всем этом диапазоне P – T (рис. 2, верхняя часть). вставка). Точно так же высокие значения удельной теплоемкости наблюдаются чуть выше температур плавления кварца, плавленого кварца, многих галогенидов щелочных металлов, кремния и германия и интерпретируются как диссоциация ближнего порядка жидкости. Высокая удельная теплоемкость Si и Ge коррелирует с аномальным структурным фактором жидкости, и существует явная связь между структурным фактором и удельной теплоемкостью для жидкости, описываемой парными взаимодействиями (уравнение 4.3,24; исх. 28). Таким образом, наблюдаемый пик в C V , вероятно, обусловлен реконфигурацией атомной упаковки от частично связанной сложной жидкости к атомарной жидкости при температуре выше 60 000 K (Ссылки представлены в дополнительной информации).
28). Таким образом, наблюдаемый пик в C V , вероятно, обусловлен реконфигурацией атомной упаковки от частично связанной сложной жидкости к атомарной жидкости при температуре выше 60 000 K (Ссылки представлены в дополнительной информации).
Неопределенности представляют собой стандартное отклонение результатов различных допущений, включая вариации ударной волны Гюгонио и параметра Грюнайссена, обсуждаемые в дополнительной информации. На вставке сравниваются температура и давление из наших измерений (красная линия) со значениями, рассчитанными при постоянной удельной теплоемкости (черная линия). Температуры для гипотетической жидкости, подчиняющиеся пределу Дюлонга-Пти, значительно превышают наши неопределенности для давлений 1,2–2. 4 тПа. Погрешности температуры идентичны тем, что показаны на рис. 2 и 3. наблюдается диссоциация 1,2,3,29 . Вполне вероятно, что большая часть этого атомарного углерода гравитационно осела в богатой углеродом фазе около ядра этих планет 1,3 . Наряду с нашими температурами плавления модельная адиабата, показанная на рис.3 предполагает, что чистый углерод может быть твердым на всех глубинах, хотя возможно, что может существовать более горячее глубокое внутреннее пространство, динамически изолированное от внешней атмосферы стабильно стратифицированной, неконвективной областью внутри Урана и Нептуна 4,30 . В таких более теплых условиях чистый углерод будет существовать в жидком металлическом состоянии, оседая из мантии, чтобы сформировать жидкое внешнее ядро, которое помогает поддерживать планетарное магнитное поле. В любом случае высокая скорость звука в богатом алмазами слое на промежуточных глубинах может влиять на планетарные нормальные моды, которые можно будет наблюдать в будущем.
4 тПа. Погрешности температуры идентичны тем, что показаны на рис. 2 и 3. наблюдается диссоциация 1,2,3,29 . Вполне вероятно, что большая часть этого атомарного углерода гравитационно осела в богатой углеродом фазе около ядра этих планет 1,3 . Наряду с нашими температурами плавления модельная адиабата, показанная на рис.3 предполагает, что чистый углерод может быть твердым на всех глубинах, хотя возможно, что может существовать более горячее глубокое внутреннее пространство, динамически изолированное от внешней атмосферы стабильно стратифицированной, неконвективной областью внутри Урана и Нептуна 4,30 . В таких более теплых условиях чистый углерод будет существовать в жидком металлическом состоянии, оседая из мантии, чтобы сформировать жидкое внешнее ядро, которое помогает поддерживать планетарное магнитное поле. В любом случае высокая скорость звука в богатом алмазами слое на промежуточных глубинах может влиять на планетарные нормальные моды, которые можно будет наблюдать в будущем.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Исследователи предсказывают материал с рекордной температурой плавления
Используя передовые компьютеры и вычислительную технику для моделирования физических процессов на атомном уровне, исследователи из Университета Брауна предсказали, что материал, сделанный из гафния, азота и углерода, будет иметь самую высокую известную температуру плавления, примерно две трети температуры на поверхности. солнца.
ПРОВИДЕНС, Род-Айленд, [Университет Брауна] — Используя мощное компьютерное моделирование, исследователи из Университета Брауна определили материал с более высокой температурой плавления, чем у любого известного вещества.
Расчеты, описанные в журнале Physical Review B (Rapid Communications) , показали, что материал, изготовленный из нужного количества гафния, азота и углерода, будет иметь температуру плавления более 4400 кельвинов (7460 градусов по Фаренгейту). . Это примерно две трети температуры на поверхности Солнца и на 200 кельвинов выше, чем самая высокая точка плавления, когда-либо зарегистрированная экспериментально.
Экспериментальный рекордсмен — вещество из элементов гафния, тантала и углерода (Hf-Ta-C).Но эти новые расчеты предполагают, что оптимальный состав гафния, азота и углерода — HfN 0,38 C 0,51 — является многообещающим кандидатом на то, чтобы установить новую отметку. Следующим шагом, который сейчас предпринимают исследователи, является синтез материала и подтверждение результатов в лаборатории.
«Преимущество начала с вычислительного подхода заключается в том, что мы можем попробовать множество различных комбинаций очень дешево и найти те, с которыми стоит поэкспериментировать в лаборатории», — сказал Аксель ван де Валле, доцент инженерных наук и соавтор исследования. учеба с постдокторантом Цицзюном Хонгом.«Иначе мы бы просто снимали в темноте. Теперь мы знаем, что у нас есть кое-что, что стоит попробовать».
учеба с постдокторантом Цицзюном Хонгом.«Иначе мы бы просто снимали в темноте. Теперь мы знаем, что у нас есть кое-что, что стоит попробовать».
«Преимущество начала с вычислительного подхода заключается в том, что мы можем очень дешево попробовать множество различных комбинаций и найти те, с которыми стоит поэкспериментировать в лаборатории».
Исследователи использовали вычислительную технику, которая определяет точки плавления путем моделирования физических процессов на атомном уровне в соответствии с законом квантовой механики. Этот метод рассматривает динамику плавления, поскольку они происходят на наноуровне, в блоках примерно из 100 атомов.Он более эффективен, чем традиционные методы, но по-прежнему требователен к вычислительным ресурсам из-за большого количества потенциальных соединений для тестирования. Работа была выполнена с использованием компьютерной сети XSEDE Национального научного фонда и высокопроизводительного компьютерного кластера Брауна «Оскар».
Ван де Валле и Хонг начали с анализа материала Hf-Ta-C, точка плавления которого уже была определена экспериментально. Моделирование позволило выявить некоторые факторы, влияющие на замечательную теплостойкость материала.
В работе показано, что Hf-Ta-C сочетает высокую теплоту плавления (энергию, выделяющуюся или поглощаемую при переходе из твердого состояния в жидкое) с небольшой разницей между энтропиями (беспорядком) твердой и жидкой фаз. «Что заставляет что-то плавиться, так это энтропия, полученная в процессе фазового превращения», — объяснил ван де Валле. «Поэтому, если энтропия твердого тела уже очень высока, это имеет тенденцию стабилизировать твердое тело и повышать температуру плавления».
Затем исследователи использовали эти результаты для поиска соединений, которые могли бы максимизировать эти свойства.Они обнаружили, что соединение с гафнием, азотом и углеродом будет иметь столь же высокую теплоту плавления, но меньшую разницу между энтропиями твердого тела и жидкости. Когда они рассчитали температуру плавления, используя свой вычислительный подход, она оказалась на 200 кельвинов выше, чем экспериментальная запись.
Когда они рассчитали температуру плавления, используя свой вычислительный подход, она оказалась на 200 кельвинов выше, чем экспериментальная запись.
Ван де Валле и Хонг теперь сотрудничают с лабораторией Александры Навроцкой в Калифорнийском университете в Дэвисе, чтобы синтезировать соединение и провести эксперименты по определению температуры плавления.Лаборатория Навроцкого оборудована для таких высокотемпературных экспериментов.
Работа может в конечном итоге привести к созданию новых высокоэффективных материалов для различных целей, от покрытия газовых турбин до теплозащитных экранов на высокоскоростных самолетах. Но неясно, будет ли само соединение HfN 0,38 C 0,51 полезным материалом, говорит ван де Валле.
«Точка плавления — не единственное важное свойство [в материалах]», — сказал он. «Вам нужно будет учитывать такие вещи, как механические свойства, стойкость к окислению и многие другие свойства.Поэтому, принимая во внимание эти вещи, вы можете смешать с этим другие вещи, которые могут снизить температуру плавления. Но поскольку вы уже начинаете так высоко, у вас больше возможностей для настройки других свойств. Поэтому я думаю, что это дает людям представление о том, что можно сделать».
Но поскольку вы уже начинаете так высоко, у вас больше возможностей для настройки других свойств. Поэтому я думаю, что это дает людям представление о том, что можно сделать».
Работа также демонстрирует мощь этой относительно новой вычислительной техники, говорит ван де Валле. В последние годы возрос интерес к использованию вычислений для изучения свойств материалов большого числа соединений-кандидатов, но большая часть этой работы была сосредоточена на свойствах, которые вычислить гораздо проще, чем температуру плавления.
«Точка плавления — действительно сложная задача прогнозирования по сравнению с тем, что делалось раньше», — сказал ван де Валле. «Для модельного сообщества, я думаю, это то, что особенного в этом».
Работа была поддержана Управлением военно-морских исследований США (N00014-12-1-0196 и N00014-14-1-0055) и Университетом Брауна за счет использования средств в его Центре вычислений и визуализации. Среда экстремальных научных и инженерных открытий (XSEDE), которая использовалась в этом исследовании, поддерживается грантом Национального научного фонда №. АКИ-1053575.
АКИ-1053575.
Физические свойства алкенов — Химия LibreTexts
Алкены содержат двойную углерод-углеродную связь. Эта углерод-углеродная двойная связь изменяет физические свойства алкенов. При комнатной температуре алкены существуют во всех трех фазах: твердой, жидкой и газообразной. Температуры плавления и кипения алкенов аналогичны температурам плавления алканов, однако изомеры цис-алкенов имеют более низкие температуры плавления, чем транс-изомеры. Алкены проявляют слабое диполь-дипольное взаимодействие из-за притягивающего электроны углерода sp 2 .
Алкены — это семейство углеводородов (соединений, содержащих только углерод и водород), содержащих двойную углерод-углеродную связь. Первые два:
- этен (\(C_2H_4\))
- пропен (\(C_3H_6\))
Вы можете вычислить формулу любого из них, используя: \(C_nH_{2n}\). Список ограничен первыми двумя, потому что после них идут изомеры, влияющие на названия.
Структурная изомерия
Все алкены с 4 и более атомами углерода проявляют структурную изомерию. Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул. Например, для C4H8 несложно получить следующие три структурных изомера:
Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул. Например, для C4H8 несложно получить следующие три структурных изомера:
Однако существует и другой изомер. Бут-2-ен также проявляет геометрическую изомерию.
Геометрическая (цис-транс) изомерия
Двойная углерод-углеродная связь не допускает вращения вокруг себя. Это означает, что группы Ch4 на любом конце молекулы могут быть заперты либо на одной стороне молекулы, либо напротив друг друга.Их называют цис-бут-2-еном (где группы находятся на одной стороне) или транс-бут-2-еном (где они находятся на противоположных сторонах).
Цис-бут-2-ен также известен как (Z)-бут-2-ен; транс-бут-2-ен также известен как (Е)-бут-2-ен. Для объяснения двух способов именования этих двух соединений.
Физическое состояние
Этен, пропен и бутен существуют в виде бесцветных газов. Члены с 5 или более атомами углерода, такие как пентен, гексен и гептен, являются жидкими, а члены с 15 или более атомами углерода являются твердыми.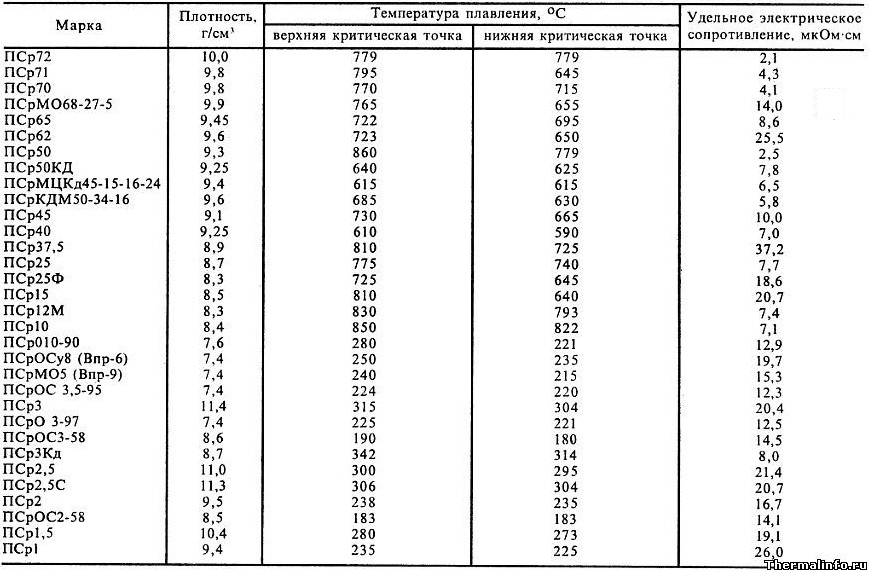
Плотность
Алкены легче воды и нерастворимы в воде из-за своих неполярных характеристик. Алкены растворяются только в неполярных растворителях.
Растворимость
Алкены практически нерастворимы в воде, но растворяются в органических растворителях. Причины этого точно такие же, как и для алканов.
Точки кипения
Температура кипения каждого алкена очень похожа на температуру кипения алкана с таким же числом атомов углерода.Этен, пропен и различные бутены являются газами при комнатной температуре. Все остальное, что вам, скорее всего, попадется, — это жидкости. Температура кипения алкенов зависит от большей молекулярной массы (длины цепи). Чем больше межмолекулярной массы добавляется, тем выше температура кипения. Межмолекулярные силы алкенов усиливаются с увеличением размера молекул.
| Соединение | Температура плавления (°C) | Температура кипения (°C) |
|---|---|---|
| Этен | -169 | -104 |
| Пропен | -185 | -47 |
| Транс-2-бутен | 0. 9 9 | |
| Цис-2-бутен | 3,7 | |
| Транс-1,2-дихлорбутен | 155 | |
| Цис-1,2-дихлорбутен | 152 | |
| 1-пентен | -165 | 30 |
| Транс-2-пентен | -135 | 36 |
| Цис-2-пентен | -180 | 37 |
| 1-гептен | -119 | 115 |
| 3-октен | -101.9 | 122 |
| 3-нонен | -81,4 | 147 |
| 5-децен | -66,3 | 170 |
В каждом случае температура кипения алкена на несколько градусов ниже, чем у соответствующего алкана. Единственным задействованным притяжением являются дисперсионные силы Ван-дер-Ваальса, и они зависят от формы молекулы и количества содержащихся в ней электронов.Каждый алкен имеет на 2 электрона меньше, чем алкан с таким же числом атомов углерода.
Точки плавления
Температура плавления алкенов зависит от упаковки молекул. Алкены имеют такие же температуры плавления, как и алканы, однако молекулы цис-изомеров упакованы в U-образную форму, поэтому их температуры плавления будут ниже, чем у транс-изомеров.
Полярность
Химическая структура и функциональные группы могут влиять на полярность соединений алкенов.Углерод sp 2 является гораздо более электроноакцепторным, чем sp3-гибридные орбитали, поэтому создает слабый диполь вдоль слабой алкенилуглеродной связи заместителя. Два отдельных диполя вместе образуют чистый молекулярный диполь. В транс-замещенных алкенах диполи компенсируют друг друга. В цис-замещенных алкенах имеется чистый диполь, что способствует более высокому кипению цис-изомеров, чем транс-изомеров.
Ссылки
- Фоллхардт, К.П.К. и Шор, Н.(2007). Органическая химия (5-е изд.). Нью-Йорк: WH Freeman (453-454)
- Фоллхардт, К.П.К. и Шор, Н.
 (2007) Органическая химия: Учебное пособие и раствор Мануэля (5-е изд.). Нью-Йорк: WH Freeman (200-202)
(2007) Органическая химия: Учебное пособие и раствор Мануэля (5-е изд.). Нью-Йорк: WH Freeman (200-202)
Проблемы
1. Соединения, содержащие двойные углерод-углеродные связи, называются:
- (а) Алканы
- (б) Алкины
- (в) Алкены
- (г) Спирты
2. Цис-алкены проявляют слабое суммарное диполь-дипольное взаимодействие:
3.Который имеет более низкую температуру плавления
- (а) 5-децен
- (б) 3-октен
- (с) цис-2-пентен
- (г) 1-пентен



 е. подвергаться гидрированию. Радикалы ненасыщенных кислот превращаются в радикалы насыщенных карбоновых кислот, и жир становится твёрдым. Так растительные масла превращают в твёрдые жиры и получают маргарин.
е. подвергаться гидрированию. Радикалы ненасыщенных кислот превращаются в радикалы насыщенных карбоновых кислот, и жир становится твёрдым. Так растительные масла превращают в твёрдые жиры и получают маргарин. Такие аксессуары отлично подходят для стрижки и укладки.
Такие аксессуары отлично подходят для стрижки и укладки.
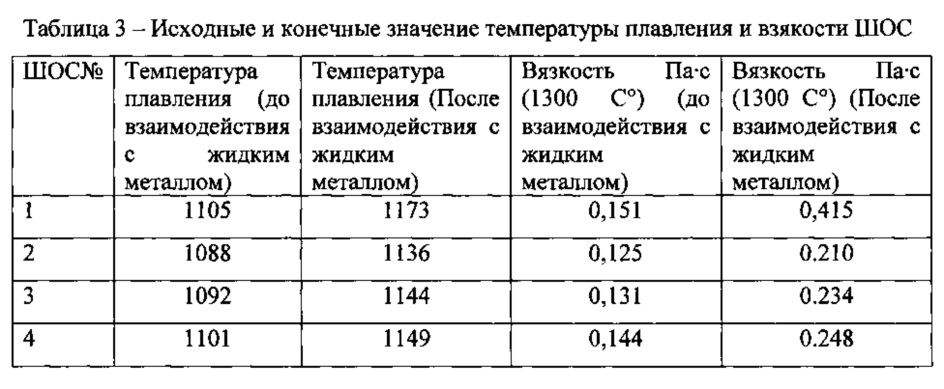 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. (2007) Органическая химия: Учебное пособие и раствор Мануэля (5-е изд.). Нью-Йорк: WH Freeman (200-202)
(2007) Органическая химия: Учебное пособие и раствор Мануэля (5-е изд.). Нью-Йорк: WH Freeman (200-202)